Dienes - nomenclature, paghahanda, katangian ng mga katangian ng kemikal. Diene hydrocarbons (alkadienes) Isomer ng dienes
Ang mga alkadienes ay isang klase ng mga hydrocarbon at may dalawang dobleng bono. Anong mga pisikal at kemikal na katangian ng alkadienes ang kilala, at ano ang mga katangian ng mga compound na ito?
Pangkalahatang katangian ng alkadienes
Ang mga alkadienes ay unsaturated hydrocarbons na may dalawang carbon-carbon double bond. Kapag ang mga dobleng bono sa alcodenes ay nasa pagitan ng dalawa o higit pang mga carbon atom, ang mga bono na ito ay itinuturing na nakahiwalay.

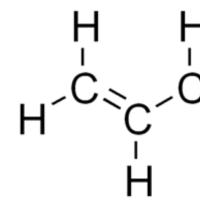
kanin. 1. Alkadienes structural formula.
Ang mga nakahiwalay na alcodenes ay kumikilos sa parehong paraan tulad ng mga alkenes sa kanilang mga kemikal na katangian. Tanging, hindi tulad ng mga alkenes, dalawang bono ang pumapasok sa reaksyon, at hindi isa.
Ang mga diene ay maaaring nasa likido o gas na estado. Ang mga lower diene ay mga likidong walang kulay, habang ang butadiene at allene ay mga gas. Ang butadiene ay ang panimulang materyal para sa paggawa ng goma.

kanin. 2. Butadiene.
Ang mga diene ay maaaring nahahati sa tatlong uri:
- conjugated, kung saan ang double bonds ay pinaghihiwalay ng single bonds;
- allenes na may dobleng bono;
- Dienes na may nakahiwalay na mga bono, kung saan ang mga dobleng bono ay pinaghihiwalay ng ilang mga solong bono.
Mga kemikal na katangian ng alkadienes
Ang mga kemikal na katangian ng mga compound ay nakasalalay sa mga dobleng bono. Ang mga alkadienes ay nailalarawan sa pamamagitan ng isang reaksyon sa karagdagan. Kung sa isang diene hydrocarbon dalawang double bond ay matatagpuan sa pamamagitan ng isang solong bono (conjugated na posisyon), pagkatapos ay mayroong karagdagang overlap ng electron density ng mga p-cloud ng dalawang p-bond sa pamamagitan ng solong bono. Ang electronic effect na ito ay tinatawag na conjugation effect, o mesomeric effect. Bilang resulta, ang mga bono ay nakahanay sa haba at enerhiya, at ang isang solong elektronikong sistema ay nabuo na may delokalisasi ng mga n-bond. Ang molekula ay maaaring tumugon sa dalawang direksyon, na may ani ng mga produkto depende sa katatagan ng mga carbocation.
Kung ang posisyon ng mga dobleng bono sa alkadiene ay hindi conjugated, kung gayon ang reaksyon sa simula ay nangyayari kasama ang alinman sa dalawang mga bono. Kapag ang isang reagent ay idinagdag, ang sunud-sunod na pagdaragdag ay nangyayari sa pamamagitan ng isa pang bono, na bumubuo ng isang limitadong tambalan.
Ang reaksyon ng karagdagan ay maaaring magpatuloy sa 2 direksyon: 1,4 at 1,2 - karagdagan. Halimbawa,
CH 2 =CH-CH=CH 2 +Br 2 =CH 2 =CH+CHBr=CH 2 Br
CH 2 =CH-CH=CH 2 +Br 2 =BrCH 2 -CH=CH-CH 2 Br
Ang mga alkadienes ay may kakayahang polimerisasyon din:
nCH 2 =CH-CH=CH 2 = (-CH 2 -CH=CH-CH 2 -)n.
Ang polymerization ay ang pagbuo ng isang molekula na may malaking molekular na timbang dahil sa kumbinasyon ng maraming mga molekula na mayroong maraming bono.
Lektura Blg. 14
· Alkadienes. Pag-uuri, katawagan, mga uri ng diene. Istraktura ng 1,3-dienes: conjugation ng mga p-bond, konsepto ng mga delokalisadong bono, paggamit ng naglilimita sa mga istruktura upang ilarawan ang istruktura ng butadiene, qualitative criteria para sa kanilang relatibong kontribusyon, conjugation energy. Mga pisikal na katangian ng conjugated alkadienes, ang kanilang mga spectral na katangian at pamamaraan ng pagkilala.
· Paraan para sa pagkuha ng conjugated dienes: Lebedev method, dehydration of alcohols, mula sa butane-butene fraction ng langis.
Ang mga diene ay mga compound na naglalaman ng dalawang carbon-carbon double bond sa isang molekula. Ang pangkalahatang formula ng homologous na serye ay C n H 2 n-2.
Depende sa pagkakaayos ng carbon-carbon double bond, ang mga diene ay nahahati sa tatlong grupo:
1) dienes na may pinagsama-samang (katabing) double bond, halimbawa, CH 2 =C=CH 2 (propadiene, allene);
2) dienes na may conjugated double bonds, halimbawa, CH 2 =CH-CH=CH2 (butadiene-1,3);
3) dienes na may nakahiwalay na double bond, halimbawa, CH 2 =CH-CH2 -CH=CH2 (pentadiene-1,4).
Ang mga diene na may pinagsama-samang dobleng bono ay mga isomer ng alkynes (halimbawa, propyne at propadiene), kung saan sila ay na-convert kapag pinainit sa pagkakaroon ng alkalis.
Ang mga diene na may nakahiwalay na mga bono ay halos hindi naiiba sa istraktura at kemikal na mga katangian mula sa mga alkenes. Ang mga ito ay nailalarawan sa pamamagitan ng mga reaksyon ng pagdaragdag ng electrophilic, na maaaring mangyari sa mga hakbang.
Ang mga conjugated diene ay may pinakamalaking teoretikal at inilapat na kahalagahan.
Sa pangkalahatan, sa organikong kimika, ang mga sistemang may conjugated bond ay yaong mga molekula kung saan ang maramihang mga bono ay pinaghihiwalay ng isang simpleng (s-) na bono. Ang pinakasimpleng conjugated system ay butadiene-1,3 o C4H6. Batay sa mga naunang sinabing ideya tungkol sa istruktura ng single, double at triple bonds, hindi mukhang kumplikado ang istruktura ng butadiene. Mayroong apat na carbon atoms sa sp 2 -hybridized na estado at konektado sa tatlong kalapit na mga atomo ng mga s-bond. Bilang karagdagan, ang overlap ng unhybridized 2 R-orbitals sa pagitan ng C-1 at C-2, pati na rin sa pagitan ng C-3 at C-4 carbon atoms ay humahantong sa pagbuo ng dalawang conjugated p-bond.
Gayunpaman, ang istraktura ng butadiene molecule ay mas kumplikado. Ito ay itinatag na ang lahat ng carbon at hydrogen atoms ay namamalagi sa parehong eroplano, kung saan ang lahat ng s-bond ay matatagpuan din. Ang mga unhybridized na p orbital ay patayo sa eroplanong ito. Ang distansya sa pagitan ng mga carbon C-1 at C-2, pati na rin sa pagitan ng mga atomo ng C-3 at C-4, ay 0.134 nm, na bahagyang mas mahaba kaysa sa haba ng double bond sa ethylene (0.133 nm), at ang distansya sa pagitan ng C-2 at C- atoms 3, katumbas ng 0.147 nm, ay makabuluhang mas mababa kaysa sa s-bond sa alkanes (0.154 nm).
kanin. 14.1. Haba ng bono (a), overlap R-orbitals (b) at delocalized MO (c) ng 1,3 butadiene molecule
Ipinakita ng data ng eksperimento na ang 1,3-butadiene ay mas matatag kaysa sa inaasahan. Ang enerhiya ng mga unsaturated compound ay kadalasang tinatantya mula sa init ng hydrogenation. Ang pagdaragdag ng isang hydrogen molecule sa isang carbon-carbon double bond, i.e. ang pagbabago ng isang unsaturated compound sa isang puspos ay sinamahan ng paglabas ng init. Kapag ang isang nakahiwalay na double bond ay hydrogenated, humigit-kumulang 127 kJ/mol ang pinakawalan. Samakatuwid, kapag ang dalawang dobleng bono ay hydrogenated, 254 kJ/mol ay dapat na inaasahan na ilalabas. Ito ay eksakto kung gaano karaming init ang inilabas sa panahon ng hydrogenation ng 1,4 pentadiene, isang tambalang may nakahiwalay na double bond. Ang hydrogenation ng 1,3 butadiene ay nagbigay ng hindi inaasahang resulta. Ang init ng hydrogenation ay naging 239 kJ/mol lamang, na 15 kJ/mol na mas mababa kaysa sa inaasahan. Nangangahulugan ito na ang butadiene ay naglalaman ng mas kaunting enerhiya (mas matatag) kaysa sa inaasahan.
Ang mga pang-eksperimentong katotohanan ay maaari lamang ipaliwanag sa pamamagitan ng mga tampok na istruktura ng butadiene (at conjugated dienes sa pangkalahatan).
Ang mga alkane, alkenes at alkynes ay binuo sa pamamagitan ng mga lokal na bono. Nabubuo ang naturang bono kapag nag-overlap ang dalawang atomic orbital (AO), at ang nagreresultang bonding molecular orbital (MO) ay two-centered at sumasaklaw sa dalawang nuclei.
Sa ilang mga sangkap ay may overlap R-Ang mga orbital ng ilang mga atomo ay bumubuo ng ilang mga MO na sumasaklaw ng higit sa dalawang mga atomo. Sa kasong ito, pinag-uusapan natin ang tungkol sa mga delocalized na koneksyon, na katangian ng mga conjugated system.
Upang ipaliwanag ang tumaas na katatagan at hindi karaniwang haba ng bono sa 1,3-butadiene molecule, apat sp 2-hybridized carbon atoms na nasa anumang conjugated diene.
Sa mga klasikal na pormula ng kemikal, ang bawat gitling ay nangangahulugang isang naisalokal na bono ng kemikal, i.e. isang pares ng mga electron. Ang mga bono sa pagitan ng una at pangalawa, pati na rin ang pangatlo at ikaapat na carbon atoms ay itinalaga bilang doble, at sa pagitan ng pangalawa at pangatlong carbon bilang solong (istraktura A). Nagsasapawan R-orbitals, na humahantong sa pagbuo ng dalawang p-bond, ay ipinapakita sa Fig. 14.1.a.
Ang ganitong pagsasaalang-alang ay ganap na binabalewala ang katotohanang iyon R-Ang mga electron ng C-2 at C-3 atoms ay maaari ding mag-overlap. Ang pakikipag-ugnayang ito ay ipinapakita gamit ang sumusunod na formula B:
Ang arko ay nagpapahiwatig ng isang pormal na bono sa pagitan ng una at ikaapat na carbon ng diene moiety. Ang paggamit ng formula B upang ilarawan ang istraktura ng butadiene molecule ay ginagawang posible na ipaliwanag ang pinababang haba ng C-2 – C-3 bond. Gayunpaman, ang mga simpleng geometric na kalkulasyon ay nagpapakita na ang distansya sa pagitan ng una at ikaapat na carbon atoms ay 0.4 nm, na makabuluhang lumampas sa haba ng isang solong bono.
Dahil ang paglalarawan ng mga istrukturang formula sa papel ay napakalimitado - ang mga linya ng valence ay nagpapakita lamang ng mga naisalokal na mga bono - Iminungkahi ni L. Pauling ang paggamit ng tinatawag na resonance theory (valence scheme method) upang mapanatili ang konsepto ng covalent bond at ang karaniwang imahe ng mga molekula.
Ang mga pangunahing prinsipyo ng konseptong ito:
· Kung ang isang molekula ay hindi mairepresenta nang tama ng isang pormula ng istruktura, kung gayon ang isang hanay ng mga istruktura ng hangganan (canonical, resonance) ay ginagamit upang ilarawan ito.
· Ang isang tunay na molekula ay hindi kasiya-siyang kinakatawan ng alinman sa mga istruktura ng hangganan, ngunit ito ay isang superposisyon ng mga ito (isang resonant hybrid).
· Ang tunay na molekula (resonance hybrid) ay mas matatag kaysa sa alinman sa mga istruktura ng resonance. Ang pagtaas sa katatagan ng isang tunay na molekula ay tinatawag na conjugation energy (delocalization, resonance).
Kapag nagsusulat ng mga istruktura ng hangganan, ang mga sumusunod na kinakailangan ay dapat matugunan:
· Ang geometry ng mga pagsasaayos ng nuklear ng mga istruktura ng hangganan ay dapat na pareho. Nangangahulugan ito na kapag nagsusulat ng mga canonical na istruktura, tanging ang electron arrangement ng mga p-bond, ngunit hindi s-bond, ang maaaring baguhin.
· Ang lahat ng canonical structure ay dapat na "Lewis structures", ibig sabihin, halimbawa, ang carbon ay hindi maaaring pentacovalent.
· Ang lahat ng mga atom na kasangkot sa conjugation ay dapat nakahiga sa parehong eroplano o malapit sa parehong eroplano. Ang kondisyon ng coplanarity ay sanhi ng pangangailangan para sa maximum na overlap p-mga orbital.
· Ang lahat ng boundary structure ay dapat magkaroon ng parehong bilang ng mga hindi magkapares na electron. Samakatuwid, ang biradical formula ng G butadiene ay hindi kanonikal.
Nasa ibaba ang mga istruktura ng hangganan ng butadiene (A at B) at ang kanilang superposisyon. Ang may tuldok na linya ay nagpapakita ng delokalisasi ng mga p-electron, i.e. na sa isang tunay na molekula ang p-electron density ay matatagpuan hindi lamang sa pagitan ng 1 at 2, 3 at 4 na carbon atoms, kundi pati na rin sa pagitan ng 2 at 3 atoms.
Kung mas matatag ang canonical na istraktura, mas malaki ang kontribusyon nito sa tunay na molekula. Ang mga istruktura ng hangganan ay isang kathang-isip, na sumasalamin sa isang posible, ngunit hindi totoo, pag-aayos ng mga p-electron. Dahil dito, ang "katatagan ng istraktura ng hangganan" ay ang katatagan ng isang kathang-isip, at hindi ng isang molekula na umiiral sa katotohanan.
Sa kabila ng katotohanan na ang mga istruktura ng hangganan ay hindi sumasalamin sa layunin ng katotohanan, ang diskarte na ito ay lumalabas na napaka-kapaki-pakinabang para sa pag-unawa sa istraktura at mga katangian. Ang "kontribusyon" ng mga istruktura ng hangganan sa tunay na conjugation ng mga p-electron ay proporsyonal sa kanilang katatagan. Ang pagtatasa na ito ay pinadali sa pamamagitan ng paggamit ng mga sumusunod na patakaran:
1) mas maraming singil ang pinaghihiwalay, mas hindi matatag ang istraktura;
2) ang mga istrukturang may hiwalay na singil ay hindi gaanong matatag kaysa sa neutral;
3) ang mga istrukturang may higit sa 2 singil ay karaniwang hindi gumagawa ng anumang kontribusyon sa conjugation;
4) ang pinaka-hindi epektibong mga istruktura ay ang mga may magkaparehong singil sa mga kalapit na atomo;
5) kung mas mataas ang electronegativity ng isang atom na may negatibong singil, mas matatag ang istraktura;
6) ang paglabag sa mga haba ng bono at mga anggulo ng bono ay humahantong sa pagbaba sa katatagan ng istraktura (tingnan ang istraktura B na nakasaad sa itaas);
7) ang isang istraktura ng hangganan na may mas maraming koneksyon ay mas matatag.
Ang paggamit ng mga patakarang ito ay nagpapahintulot sa amin na sabihin na kahit na pormal na ang molekula ng ethylene ay maaaring ilarawan sa pamamagitan ng dalawang mga istruktura ng hangganan na M at H (tingnan sa ibaba), ang kontribusyon ng istraktura ng H na may hiwalay na mga singil ay napakaliit na maaari itong ibukod mula sa pagsasaalang-alang.
Ang partikular na atensyon ay dapat bayaran sa double-edged, tinatawag na, na ginagamit para sa paglipat sa pagitan ng mga istruktura ng hangganan. "resonance" na arrow. Ang tanda na ito ay nagpapahiwatig na ang mga itinatanghal na istruktura ay kathang-isip lamang.
Ang isang matinding pagkakamali ay ang paggamit, kapag naglalarawan ng mga istruktura ng hangganan, ang dalawang arrow na unidirectional sa iba't ibang direksyon, na nagpapahiwatig ng paglitaw ng isang mababalik na reaksyon. Ang isang parehong malubhang pagkakamali ay ang paggamit kapag naglalarawan ng isang proseso ng balanse, i.e. tunay na umiiral na mga molekula, isang "malagong" na arrow.
Kaya, sa butadiene molecule dahil sa conjugation R-orbitals ng apat na carbon atoms, isang pagtaas sa p-electron density ay sinusunod sa pagitan ng ikalawa at ikatlong carbon atoms. Ito ay humahantong sa ilang dobleng pagbubuklod ng C-2 at C-3, na makikita sa pagbaba ng haba ng bono sa 0.147 nm, kumpara sa nag-iisang haba ng bono na 0.154 nm.
Upang makilala ang mga bono sa organikong kimika, ang konsepto ng "order ng bono" ay kadalasang ginagamit, na tinukoy bilang ang bilang ng mga covalent bond sa pagitan ng mga atomo. Maaaring kalkulahin ang pagkakasunud-sunod ng bono gamit ang iba't ibang paraan, isa na rito ay upang matukoy ang distansya sa pagitan ng mga atomo at ihambing ito sa mga haba ng bono ng ethane (carbon-carbon bond order ay 1), ethylene (bond order 2) at acetylene (bond order 3 ). Sa butadiene-1,3, ang C 2 -C 3 bond ay may order na 1.2. Ang halagang ito ay nagpapahiwatig na ang koneksyon na ito ay mas malapit sa karaniwan, ngunit ang ilang duality ay naroroon. Ang pagkakasunud-sunod ng mga bono C 1 -C 2 at C 3 -C 4 ay 1.8. Bilang karagdagan, ito ay conjugation na dapat ipaliwanag ang mataas na katatagan ng butadiene, na ipinahayag sa mababang halaga ng init ng hydrogenation (isang pagkakaiba ng 15 kJ / mol - ang conjugation energy).
Sa organic chemistry, ang conjugation (delocalization) ay palaging ay itinuturing na nagpapatatag, i.e. salik na nagpapababa ng enerhiya ng molekula.
Alcadienes(dienes) ay unsaturated aliphatic hydrocarbons, ang mga molekula nito ay naglalaman ng dalawang double bond. Ang pangkalahatang formula ng alkadienes ay C n H 2n -2.
Ang mga katangian ng alkadienes ay higit na nakasalalay sa kamag-anak na pag-aayos ng mga dobleng bono sa kanilang mga molekula. Batay sa tampok na ito, tatlong uri ng double bond sa dienes ay nakikilala:
1) nakahiwalay ang mga dobleng bono ay pinaghihiwalay sa isang kadena ng dalawa o higit pang mga s-bond:
CH 2 =CH–CH2 –CH=CH2 (hiniwalay sp 3 -carbon atoms, ang gayong mga double bond ay hindi magkaparehong nakakaimpluwensya sa isa't isa at pumapasok sa parehong mga reaksyon gaya ng double bond sa mga alkenes);
2) pinagsama-sama Ang mga dobleng bono ay matatagpuan sa isang carbon atom:
Ang CH 2 =C=CH 2 (mga diene (allenes) ay hindi gaanong matatag kaysa sa ibang mga diene at, kapag pinainit sa isang alkaline na medium, muling ayusin sa mga alkynes);
3) conjugate dobleng bono na pinaghihiwalay ng isang s-bond:
CH 2 =CH–CH=CH2.
Ang mga conjugated diene ay pinaka-interesante. Ang mga ito ay nakikilala sa pamamagitan ng mga katangian ng katangian dahil sa elektronikong istraktura ng mga molekula, ibig sabihin, isang tuluy-tuloy na pagkakasunud-sunod ng apat. sp 2 - mga atomo ng carbon. Ang lahat ng mga carbon atom ay namamalagi sa parehong eroplano, na bumubuo ng isang s-skeleton. Ang unhybridized p-orbitals ng bawat carbon atom ay patayo sa s-skeletal plane at parallel sa isa't isa, na magkakapatong, na bumubuo ng isang solong p-electron cloud. Ang espesyal na uri ng mutual na impluwensya ng mga atom ay tinatawag na conjugation.
Overlap ng p-orbitals mga molekula ng butadiene nangyayari hindi lamang sa pagitan ng C 1 – C 2, C 3 – C 4, kundi sa pagitan din ng C 2 – C 3. Sa bagay na ito, ang terminong "conjugate system" ay ginagamit. Ang kinahinatnan ng delokalisasi ng densidad ng elektron ay ang mga haba ng C 1 – C 2 (C 3 – C 4) na mga bono ay nadagdagan kumpara sa haba ng dobleng bono sa ethylene (0.132 nm) at umaabot sa 0.137 nm; sa turn, ang haba ng C 3 – C 4 bond ay mas mababa kaysa sa ethane C – C (0.154 nm) at umaabot sa 0.146 nm. Ang mga diene na may conjugated system ng double bonds ay mas energetically paborable.
Alkadiene nomenclature
Ayon sa mga panuntunan ng IUPAC, ang backbone ng isang molekula ng alkadiene ay dapat na kasama ang parehong double bond. Ang mga carbon atom sa kadena ay binibilang upang ang mga dobleng bono ay makatanggap ng pinakamababang mga numero. Ang mga pangalan ng alkadienes ay nagmula sa mga pangalan ng kaukulang alkanes (na may parehong bilang ng mga carbon atom) na may pagdaragdag ng pagtatapos - diene.
Mga uri ng isomerism ng alkadienes:
Structural isomerism:
1) isomerism ng posisyon ng conjugated double bonds;
2) isomerism ng carbon skeleton;
3) interclass (isomeric hanggang alkynes)
Spatial isomerism — ang mga diene na may iba't ibang substituent sa mga carbon atom ng dobleng bono, tulad ng mga alkenes, ay nagpapakita ng cis-trans isomerism.

Mga pamamaraan para sa paggawa ng alkadienes

Mga kemikal na katangian ng alkadienes

Ang mga conjugated dienes ay nailalarawan sa pamamagitan ng mga reaksyon ng karagdagan (mga reaksyon 1, 2). Ang pagkakaroon ng isang conjugated system ng p-electrons ay humahantong sa mga kakaibang reaksyon ng karagdagan. Ang conjugated dienes ay may kakayahang mag-attach hindi lamang sa double bonds (C 1 at C 2, C 3 at C 4), kundi pati na rin sa terminal (C 1 at C 4) na carbon atoms sa pamamagitan ng pagbuo ng double bond sa pagitan ng C 2 at C 3 . Ang ratio ng 1,2- at 1,4-addition na mga produkto ay nakasalalay sa temperatura kung saan isinagawa ang eksperimento at sa polarity ng solvent na ginamit.
Reduction (reaksyon 3) na may tinatawag na reduction na may hydrogen sa sandali ng ebolusyon (hydrogen ay inilabas kapag ang sodium at alkohol ay tumutugon). Ang mga alkenes ay hindi nababawasan sa ilalim ng mga ganitong kondisyon; ito ay isang natatanging katangian ng conjugated dienes.
Ang polymerization (reaksyon 4) ay ang pinakamahalagang pag-aari ng conjugated dienes, na nangyayari sa ilalim ng impluwensya ng iba't ibang mga catalyst (AlCl 3, TiCl 4 + (C 2 H 5) 3 Al) o liwanag. Kung ang ilang mga catalyst ay ginagamit, posible na makakuha ng isang polymerization na produkto na may isang tiyak na configuration ng chain.
Ang natural na goma ay may configuration ng cis. Ang mga macromolecule ng natural na goma ay may helical chain structure dahil sa ang katunayan na ang isoprene unit ay baluktot, na lumilikha ng spatial obstacles sa order na pag-aayos ng mga chain. Sa goma, ang mga mahahabang molekula ay pinipilipit at nakakabit sa isa't isa sa isang helix. Kapag ang goma ay nakaunat, ang mga spiral ay nag-uunat, at kapag ang pag-igting ay naalis, sila ay kumukulot muli. Ang isa pang polymer ng isoprene, gutta-percha, ay umiiral sa kalikasan (trans configuration). Ang Gutta-percha ay may parang baras na istraktura ng chain dahil sa straightness ng isoprene units (chain na may trans configuration ng double bonds ay maaaring matatagpuan nang isa laban sa isa), kaya ang gutta-percha ay isang matigas ngunit malutong na polimer. Ilang bansa ang may natural na goma at samakatuwid ito ay pinalitan ng mga sintetikong goma na gawa sa divinyl at gayundin mula sa isoprene.


Para sa praktikal na paggamit, ang mga goma ay ginagawang goma.
Ang goma ay vulcanized na goma na may tagapuno (carbon black). Ang kakanyahan ng proseso ng bulkanisasyon ay ang pag-init ng pinaghalong goma at asupre ay humahantong sa pagbuo ng isang three-dimensional na istraktura ng network ng mga linear na macromolecule ng goma, na nagbibigay ng mas mataas na lakas. Ang mga atomo ng sulfur ay nakakabit sa dobleng mga bono ng mga macromolecule at bumubuo ng mga cross-linking disulfide bridges sa pagitan nila.
Ang polymer ng network ay mas matibay at nagpapakita ng mas mataas na pagkalastiko - mataas na pagkalastiko (ang kakayahang sumailalim sa mataas na nababaligtad na mga deformation).
Depende sa dami ng ahente ng crosslinking (sulfur), maaaring makuha ang mga meshes na may iba't ibang frequency ng crosslinking. Ang sobrang cross-link na natural na goma - ebonite - ay walang pagkalastiko at isang matigas na materyal. 
Pangkalahatang katangian ng alkadienes
Ang mga alkadienes ay mga kinatawan ng unsaturated hydrocarbons na naglalaman ng dalawang dobleng bono sa kanilang carbon skeleton, samakatuwid sila ay tinatawag ding diene hydrocarbons.
Ngunit ano ang pangkalahatang pormula ng homologous na serye ng mga alkadienes:
CnH2n-2.
Ngunit, ang formula na ito ay tumutugma din sa homologous na serye ng mga alkynes, pati na rin sa mga cycloalkenes.
Ang pagkakaroon ng dalawang dobleng bono sa isang molekula ay ipinahiwatig ng pangalan ng klase, kung saan ang "di" ay nangangahulugang dalawa, at ang "en" ay isinalin bilang isang bono, iyon ay, isang dobleng bono.
Pag-uuri ng dienes
Dapat ding tandaan na, depende sa kamag-anak na posisyon ng mga dobleng bono, ang mga diene ay maaaring nahahati sa mga grupo tulad ng:
Unang pangkat
Cumulated dienes. Ito ay mga compound na ang mga molekula ay may dalawang double bond na matatagpuan sa parehong carbon atom (1,2-dienes)
Pangalawang pangkat
Conjugated dienes. Kabilang dito ang mga alkadienes, mga molekula kung saan mayroong dalawang dobleng bono na pinaghihiwalay ng isa o isang solong bono:
Ganito ang hitsura minsan ng mga alkadienes na may conjugated bond:
CH2-CH-CH-CH2
Ikatlong pangkat
Isolated dienes. Kabilang dito ang mga compound kung saan ang mga molekula ay may dalawang dobleng bono at, bukod dito, ang mga dobleng bono na ito ay pinaghihiwalay ng ilang solong bono.
CH2=CH-CH2-CH=CH2
Isomerismo at katawagan
Kung isasaalang-alang natin ang isometry ng alkadienes, dapat sabihin na sila ay nailalarawan sa pamamagitan ng parehong istruktura at spatial na isometry.
Sa figure sa ibaba makikita natin ang mga halimbawa ng structural at spatial isometry:

Tulad ng para sa pag-compile ng mga pangalan ng alkadienes, ang mga sumusunod na patakaran ay umiiral:
Una, ang pangunahing kadena ay kinakailangang naglalaman ng dalawang dobleng bono;
Pangalawa, ang pagnunumero, bilang panuntunan, ay nagsisimula sa dulo kung saan pinakamalapit ang maramihang bono;
Pangatlo, binibigyan nila ng mga pangalan ang mga kahalili at ipinapahiwatig ang mga atomo ng carbon kung saan sila nanggaling;
Ikaapat, ang mga carbon atom ay nagbibigay sa alkadiene ng pangalan nito, kadalasan mula sa mga atomo kung saan nabuo ang dobleng bono.
Paghahanda ng alkadienes
Kung isasaalang-alang namin ang isyu ng pagkuha ng dienes, kung gayon, bilang panuntunan, ginagamit namin ang:
1. Paraan ng S.V. Sa tulong nito, itinatag ng industriya ang paggawa ng butadiene mula sa ethyl alcohol. Ang pamamaraang ito, na binuo ni Lebedev, ay batay sa reaksyon:
425 °C, Al2O3, ZnO
2CH3-CH2-OH -----------------> CH9=CH-CH=CH9 + 2H2O + H2

Si Sergei Vasilievich Lebedev ay isang sikat na chemist na nakatuon sa kanyang siyentipikong pananaliksik sa polymerization, isomerization at hydrogenation ng unsaturated hydrocarbons. Sa pamamagitan ng polymerizing 1,3-butadiene sa ilalim ng impluwensya ng sodium, nakuha niya ang sintetikong goma.
2. Paraan ng dehydrogenation. Ang isa sa mga karaniwang pang-industriya na pamamaraan para sa paggawa ng 1,3 butadiene ay catalytic dehydrogenation n-butane, na nakahiwalay sa mga bahagi ng pagdadalisay ng langis:
CH3-CH2-CH2-CH3 -> CH2=CH-CH=CH2 + 2H2
Kung isasaalang-alang ang prosesong ito, sa unang yugto nito, parehong butene-1 at butene-2 ay maaaring mabuo.

Ang Isoprene (2-methylbutadiene-1,3) ay nakuha sa pamamagitan ng dehydrogenation ng 2-methylbutane.
3. Paraan ng dehydrohalogenation. Upang makakuha ng mga alkadienes, maaari kang gumamit ng isang karaniwang pamamaraan ng laboratoryo, na siyang paraan ng reaksyon ng pag-aalis.
Kapag ang isang alkohol na solusyon ng alkali ay nalantad sa dibromoalkanes, maaari nating obserbahan ang proseso ng pag-aalis ng dalawang molekula ng hydrogen halide at ang pagbuo ng dalawang dobleng bono:

Mga katangiang pisikal
Tulad ng para sa mga pisikal na katangian ng alkadienes, na may isang nakahiwalay na dobleng bono, mayroon silang parehong mga katangian tulad ng mga ordinaryong alkenes.
Sa ilalim ng normal na mga kondisyon, ang 1,3-butadiene ay isang madaling tunaw na gas na may medyo hindi kanais-nais na amoy. At ang isoprene at iba pang mas mababang diene ay walang kulay, mababang kumukulo na likido. Tulad ng para sa mas mataas na dienes, ipinakita ang mga ito sa anyo ng mga solido.
Mga katangian ng kemikal
Tulad ng alam mo na, ang mga kemikal at pisikal na katangian ng mga alkadiena ay magkapareho sa mga alkenes, bagaman ang mga alkadienes na may conjugated na mga bono ay may sariling mga nuances at mas aktibo.
1. Ang mga alkadienes ay nailalarawan sa pamamagitan ng isang reaksyon sa karagdagan, at sila ay may kakayahang magdagdag ng parehong hydrogen at halogens at hydrogen halides.
Ang pangunahing tampok ng dienes ay mayroon silang kakayahang magdagdag ng hindi lamang isang 1,2 molekula, kundi pati na rin isang 1,4 na karagdagan na produkto:

Ang ginustong kurso ng reaksyon ay karaniwang nakasalalay sa mga kondisyon at paraan ng pagpapatupad.
2. Ang susunod na kemikal na katangian ng dienes ay ang polymerization reaction. Maaari itong mangyari sa ilalim ng impluwensya ng mga kasyon o mga libreng radikal. Kadalasan, ang polimerisasyon ng mga compound na ito ay nagreresulta sa pagbuo ng mga polimer na may mga katangian na kahawig ng natural na goma. Samakatuwid, maaari nating sabihin na ang pangunahing lugar ng aplikasyon ng butadiene at isoprene ay ang paggawa ng sintetikong goma.
Natural at sintetikong goma. goma
Hanggang ang tao ay natutong gumawa ng sintetikong goma, ang natural na goma ay ginamit sa industriya. Ang nasabing goma ay nakuha gamit ang mga halaman na may goma sa pamamagitan ng pagkuha ng milky juice, iyon ay, ang tinatawag na latex. Ang Hevea, na lumalaki sa Latin America, ay itinuturing na pinakamahalagang halaman para sa paggawa ng natural na goma.
Ang isang malaking halaga ng pananaliksik ay isinagawa sa lugar na ito, na nagsiwalat na ang natural na goma ay naglalaman ng cis-polyisoprene, iyon ay, ito ay isang polimer na ang istraktura ay tumutugma sa isoprene (2-methylbutadiene-1,3).
Ngunit salamat sa iba't ibang mga eksperimento at pananaliksik, ang Amerikanong imbentor na si Charles Nelson Goodyear ay nakapag-vulcanize ng goma. Natuklasan niya na kapag ang goma ay pinainit ng asupre, ang resulta ay isang medyo nababanat na materyal, na higit pa sa goma sa mga teknikal na katangian. Ito ay kung paano nakuha ni Goodyear ang goma.
Si Charles Nelson, pagkatapos magsagawa ng bulkanisasyon, ay napansin na dahil sa mga tulay na sulfide, ang mga polymer chain ay cross-linked at, bilang isang resulta, ang lakas at paglaban sa iba't ibang mga organikong sangkap at mga solvent ay tumataas.

At dahil nagsimula ang mabilis na paglago ng industriya noong ikadalawampu siglo, tumaas din ang pangangailangan para sa goma. Ngunit ang paggamit ng natural na goma sa isang pang-industriya na sukat ay hindi kumikita at medyo mahal, kaya ang mga siyentipiko ay kailangang maghanap ng mga paraan upang makagawa ng sintetikong goma.
Ngunit, sa una, hindi lahat ay napakasimple sa lugar na ito, at ang unang goma na nakuha ay malabo na kahawig ng dagta, na, bukod dito, ay napakahina ng kalidad kapag na-vulcanize.
Tulad ng alam mo na, mula sa aralin ngayon, ang sintetikong goma ay nakuha gamit ang pamamaraan ng chemist S.V Lebedev lamang noong 1932, kung saan ang produksyon nito ay nakakuha ng isang pang-industriya na sukat.
Itong teknolohikal na maginhawang pamamaraan para sa paggawa ng goma ay batay sa polimerisasyon ng 1,3 butadiene gamit ang isang katalista tulad ng sodium metal.
Salamat sa teknolohiyang ito, posible na makakuha ng polybutadiene, na may medyo mahusay na mga teknolohikal na katangian. Ngunit dito, masyadong, hindi lahat ay kasing makinis gaya ng gusto namin, dahil ang nagresultang polimer ay hindi stereo-regular at, nang naaayon, ang goma na ginawa sa batayan nito ay hindi partikular na nababanat at mas mababa sa kalidad ng goma na nakuha mula sa natural na goma .
Ngunit ang mga siyentipiko ay nakakuha lamang ng isoprene at stereoregular polymers noong ikalimampu ng ikadalawampu siglo.
Siyempre, sa kasalukuyan, ginagawang posible ng mga modernong teknolohiya sa industriya ng kemikal na makagawa ng hindi isa, ngunit ilang uri ng sintetikong goma. Ang mga uri ng sintetikong goma gaya ng isoprene, butadiene, chloroprene, styrene, atbp. ay malawakang ginagamit bilang monomer.
Gayundin, ang goma, na ginawa batay sa mga copolymer ng alkadienes na may dobleng mga bono, pati na rin ang mga derivatives ng alkene, ay napakapopular.
Ang mga uri ng goma ay nailalarawan sa pamamagitan ng: mahusay na pagkalastiko, lakas at paglaban sa hamog na nagyelo. Bilang karagdagan, ang mga uri ng goma ay nabawasan ang pagkamatagusin ng gas at lumalaban din sa ultraviolet radiation at iba't ibang mga ahente ng oxidizing.
Takdang aralin
Sagutin ang mga tanong at lutasin ang mga gawaing ito.