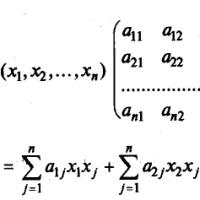Konstruksyon ng mga kinetic na modelo ng mga reaksiyong kemikal. Ang perpektong solusyon para sa lahat ng mga operasyon ng proseso sa industriya ng kemikal at proseso. Produkto: chemical reaction module
PRODUKTO: Chemical Reactions Module
Gayahin ang init at mass transfer gamit ang Chemical Reactions module
Isang plate reactor kung saan nangyayari ang mga kemikal na reaksyon sa lahat ng dako at ang mga reactant ay ipinapasok sa dalawang punto.
Tamang-tama na solusyon para sa lahat ng pagpapatakbo ng proseso sa industriya ng kemikal at proseso
Ang pag-optimize ng mga kemikal na reaktor, kagamitan sa pagsasala, mga mixer at iba pang proseso ay pinasimple gamit ang module ng Chemical Reaction Engineering. Naglalaman ito ng mga tool para sa pagmomodelo ng transportasyon ng materyal at paglipat ng init para sa anumang kinetika ng kemikal sa anumang uri ng kapaligiran (mga gas, likido, porous na media, mga ibabaw at solido) o mga kumbinasyon nito. Samakatuwid, ang module ay isang mainam na solusyon para sa lahat ng aspeto ng industriya ng kemikal at proseso, at maging sa environmental engineering kung saan ang kapaligiran ay ang "process plant" o "chemical reactor".
Convection at diffusion na may di-makatwirang kinetika ng kemikal
Ang module ng Chemical Reaction Engineering ay nagbibigay ng mga intuitive na interface ng gumagamit para sa pagtukoy ng transportasyon ng mga materyales sa dilute at concentrated na solusyon o mixture sa pamamagitan ng convection, diffusion, at ion migration ng isang arbitrary na bilang ng mga kemikal na compound. Ang lahat ng mga ito ay madaling nauugnay sa mga kahulugan ng kinetics ng nababaligtad, hindi maibabalik at equilibrium na mga reaksyon, na inilarawan ng Arrhenius equation o anumang arbitrary reaction rate equation, at ang mga epekto ng konsentrasyon at temperatura sa kinetics ay maaaring isaalang-alang. Ang interface para sa pagtukoy ng mga kemikal na reaksyon ay simple at malinaw, dahil ang mga kemikal na formula at equation ay halos ipinasok na parang nakasulat sa papel. Gamit ang batas ng mass action, ang COMSOL ay bumubuo ng mga angkop na pattern ng reaksyon na maaaring baguhin o tanggihan. Ang Stoichiometry sa mga formula ng reaksyon ay ginagamit upang awtomatikong matukoy ang mga balanse ng materyal at enerhiya para sa homogenous o heterogenous na mga kondisyon ng reaktor, nang maramihan o sa mga ibabaw.
Mga karagdagang larawan na may mga halimbawa:




Phenomena ng kumpletong paglilipat
Ang mga tool para sa pagkalkula ng mga katangian ng thermodynamic, kabilang ang mula sa mga panlabas na mapagkukunan, ay kasama sa module ng Chemical Reaction Engineering upang idagdag ang koneksyon ng paglipat ng init na may mga balanse ng enthalpy sa paglipat ng masa at mga reaksiyong kemikal. Mayroon ding mga user interface para sa pagtukoy ng paglipat ng momentum, na nagbibigay-daan sa iyong i-account ang lahat ng mga phenomena ng paglilipat na naroroon sa iyong proseso. Sa partikular, ang laminar flow at flow sa porous na media, na inilarawan ng Navier–Stokes equation, Darcy's law at Brinkman equation, ay isinasaalang-alang. Gamit ang CFD (Computational Fluid Dynamics) o Heat Transfer module sa modelo, maaari mong isaalang-alang ang magulong daloy, multiphase flow at non-isothermal na daloy, gayundin ang radiative heat transfer.
Isang mahalagang bahagi ng pag-optimize ng iyong mga proseso ng reaksyong kemikal
Ang module ng Chemical Reaction Engineering ay inilaan para sa mga inhinyero at siyentipiko na nagtatrabaho, halimbawa, sa mga industriya ng kemikal, proseso, kapangyarihan, parmasyutiko, pagkain, o polimer, kung saan ang paglipat ng materyal at mga reaksiyong kemikal ay isang mahalagang bahagi ng proseso. Ang module ay naglalaman ng mga tool para sa lahat ng aspeto ng aplikasyon: mula sa test-tube research sa laboratoryo hanggang sa overhaul ng isang chemical reactor sa isang planta. Maaaring gayahin ang mga kemikal na kinetika sa mga kinokontrol na kapaligiran upang ilarawan ang mga ito nang detalyado, gamit ang mga built-in na kakayahan para sa pagtatantya ng parameter at paghahambing sa pang-eksperimentong data. Gayunpaman, ang module ng Chemical Reaction Engineering ay may ilang mga pre-configured na uri ng reactor para sa mas malalim na pananaliksik:
- Mga batch at semi-batch na reactor* Mga reactor na patuloy na hinahalo sa daloy* Mga reaktor ng plug-flow
Ang mga uri ng reactor na ito ay binibigyan ng mga kinakailangang kahulugan ng pare-pareho o variable na masa at volume, pati na rin ang isothermal, non-isothermal at adiabatic na kondisyon. Ang mga simpleng modelong ito ay perpekto para sa pagpapatupad ng mga na-optimize na kinetics sa kapaligiran ng proseso, na nagbibigay-daan para sa mas mahusay na pag-unawa sa system at pagmomodelo ng maraming iba't ibang mga kondisyon ng operating. Sa lahat ng kaalamang ito sa kamay, ang susunod na hakbang ay i-optimize ang disenyo ng halaman at mga kondisyon ng pagpapatakbo gamit ang isang buong 2D axisymmetric o 3D na modelo. Ang function na Bumuo ng Space-Dependent Model ay maaaring gamitin upang komprehensibong isaalang-alang ang balanse ng masa at enerhiya ng isang system, na isinasaalang-alang ang mga rate ng daloy at mga reaksiyong kemikal.
Module Mga reaksiyong kemikal
Pangunahing tampok
- Mga modelo ng mga awtomatikong ideal na reactor na may output ng mga kinetic equation batay sa mga kemikal na formula
- Mass transfer sa dilute at concentrated mixtures
- Mass transfer sa pamamagitan ng diffusion, convection at ion migration
- Multicomponent mass transfer
- Fickian, Nernst-Planck, Maxwell-Stefan equation, pati na rin ang transport na average sa isang mixture
- Accounting para sa microcomponent diffusion para sa Soret effect
- Pagsasabog sa manipis na mga layer
- Mga hadlang sa pagsasabog
- Transport ng mga substance at heat transfer sa porous media
- Mga modelo ng pagsasaayos ng porosity para sa mga parameter ng mass transfer
- Laminar flow at flow sa porous media
- Formula ng Hagen-Poiseuille
- Navier - Stokes, Brinkman equation at batas ni Darcy
- Daloy ng reaksyon
- Pagsasabog ng ibabaw at mga reaksyon
- Adsorption, absorption at deposition ng mga substance sa ibabaw
- Multilevel transfer at mga katangian ng reaksyon
- Walang limitasyong bilang ng mga kemikal sa mga arbitrary na kahulugan ng mga kinetika ng reaksyong kemikal sa mga isothermal at non-isothermal na kapaligiran
- Modelo ng Arrhenius
- Adsorption isotherms, absorption at deposition ng mga substance sa ibabaw
- Daloy ng reaksyon sa libre at buhaghag na media
- CHEMKIN® function para sa pag-import ng kinetic data, thermodynamic at transport properties
- Suporta para sa mga thermodynamic database sa CAPE-OPEN na format
Lugar ng aplikasyon
- Batch, pulsed flow at vessel reactors
- Disenyo ng reaktor, sukat at pag-optimize
- Transportasyon ng microcomponent at lamad
- Naka-pack na mga reaktor ng kama
- Adsorption, absorption at deposition sa mga ibabaw
- Biochemistry at teknolohiya ng pagkain
- Pagbubuo ng parmasyutiko
- Produksyon ng mga plastik at polimer
- Teknolohiyang electrochemical
- Chromatography
- Osmosis, electrophoresis at electroosmosis
- Pagsala at sedimentation
- Paggamot ng maubos na gas at pagbabawas ng mga nakakapinsalang emisyon
- Fermentation at crystallization device
- Mga cyclone, separator, scrubber at leaching unit
- Mga pre-combustion chamber at internal combustion engine
- Mga monolitikong reaktor at catalytic converter
- Selective catalytic reduction at mga catalyst para dito
- Mga repormador ng hydrogen
- Pagproseso ng semiconductor at pag-deposito ng singaw ng kemikal
- Microhydraulic at lab-on-a-chip na mga device
Mga Materyal na Database
1 Pinapayagan ang anumang format ng file, ito ang mga pinakakaraniwang extension
2 Nangangailangan ng Plasma Module
3 Ang anumang extension ay pinapayagan; Ito ang mga pinakakaraniwang extension
Module Mga reaksiyong kemikal
Stephen Mackintosh
Lifescan Scotland
UK
T. Schauer, I. Guler
Boston Scientific Corporation, MN, USA
Stephen Mackintosh Lifescan Scotland UK
Ang Lifescan Scotland ay isang kumpanya ng medikal na aparato na nagdidisenyo at gumagawa ng mga blood glucose monitoring kit para sa pandaigdigang merkado ng diabetes. Kabilang dito ang pagsubaybay sa sarili ng mga antas ng glucose sa dugo sa pamamagitan ng mga espesyal na sistema ng pagsubaybay at mga test strip na binubuo ng isang plastic substrate, dalawang carbon-based na electrodes, isang manipis na dry reagent layer, at ...
T. Schauer, I. Guler Boston Scientific Corporation, MN, USA
Ang pagpasok ng stent sa pamamagitan ng coronary artery ay isang karaniwang pamamaraan na ginagamit upang gamutin ang pinaghihigpitang daloy ng dugo sa puso na dulot ng stenosis. Kasunod ng pamamaraan, maaaring mangyari ang restenosis dahil sa labis na paglaki ng tissue sa paligid ng stent. Gumagamit ang mga mananaliksik sa Boston Scientific ng multiphysics simulation para mas maunawaan kung paano ang drug-eluting stent ...
Module Mga reaksiyong kemikal
Ang chemical vapor deposition (CVD) ay nagbibigay-daan sa isang manipis na pelikula na lumaki sa isang substrate sa pamamagitan ng mga molekula at molekular na fragment na nag-adsorb at nagre-react sa isang ibabaw. Inilalarawan ng halimbawang ito ang pagmomodelo ng naturang CVD reactor kung saan unang nabubulok ang triethyl-gallium, at ang mga produkto ng reaksyon kasama ng arsin (AsH3).<{:/sub>) sumisipsip at tumutugon sa isang...
Ang isa sa mga pinaka-karaniwang reactor sa industriya ng kemikal, para sa paggamit sa mga heterogenous catalytic na proseso, ay ang naka-pack na bed reactor. Ang ganitong uri ng reactor ay ginagamit kapwa sa synthesis gayundin sa effluent treatment at catalytic combustion. Ang modelong ito ay naka-set up upang kalkulahin ang pamamahagi ng konsentrasyon sa reactor gas na dumadaloy sa paligid ng ...
Ginagaya ng modelo ang non-premixed turbulent combustion ng syngas (synthesis gas) sa isang simpleng round-jet burner. Ang Syngas ay isang halo ng gas, na pangunahing binubuo ng hydrogen, carbon monoxide at carbon dioxide. Ang pangalang syngas ay nauugnay sa paggamit nito sa paglikha ng synthetic natural gas. Sa modelo, ang syngas ay pinapakain mula sa isang tubo patungo sa isang bukas na rehiyon na may mabagal ...
Ang mga reaksyon sa ibabaw na may mga hakbang sa adsorption-reaksyon-desorption ay karaniwan sa halimbawa ng photocatalysis at biosensors. Ang isang flow cell sa isang biosensor ay naglalaman ng isang hanay ng mga micropillar para sa adsorption ng halimbawa ng mga antigen sa mga may tubig na solusyon. Ang isang signal na proporsyonal sa saklaw ng ibabaw ay maaaring makita sa isang sensor, halimbawa sa pamamagitan ng ...
Ang dialysis ay isang malawakang ginagamit na paraan ng paghihiwalay ng mga uri ng kemikal. Ang isang halimbawa ay ang hemodialysis, na nagsisilbing artipisyal na bato para sa mga taong may kabiguan sa bato. Sa dialysis, tanging ang mga partikular na sangkap ang pinapayagang kumalat sa lamad, batay sa mga pagkakaiba sa laki ng molekular at solubility. Ginagaya ng Membrane Dialysis app ang isang proseso para sa ...
Ang high-performance liquid chromatography (HPLC) ay isang karaniwang paraan ng paghihiwalay, pagtukoy, at pagbibilang ng bawat kemikal na compound sa isang timpla. Ang HPLC ay matatagpuan sa industriya ng parmasyutiko, biotech, at pagkain. Ginagaya ng Liquid Chromatography app ang paghihiwalay ng dalawang species sa loob ng generic na column ng liquid chromatography. Ang mga simulation ay maaaring...
Sa tutorial na ito, ang mga heat at mass transport equation ay pinagsama sa laminar flow upang mai-modelo ang mga exothermic na reaksyon sa isang parallel plate reactor. Ito ay nagpapakita kung paano mo magagamit ang COMSOL Multiphysics upang sistematikong i-set up at lutasin ang mga nagiging sopistikadong modelo gamit ang mga paunang natukoy na interface ng pisika.
Ang pagmomodelo ng mga naka-pack na kama, monolithic reactor, at iba pang catalytic heterogeneous reactor ay lubos na pinasimple gamit ang Reacting Flow sa Porous Media multiphysics interface. Tinutukoy nito ang diffusion, convection, migration, at reaksyon ng mga kemikal na species para sa porous na daloy ng media nang hindi kinakailangang mag-set up ng hiwalay na mga interface at ikonekta ang mga ito. Ang...
Sa mga fuel cell power generator, ang isang steam reformer unit ay karaniwang gumagawa ng hydrogen na kailangan para sa cell stack. Ang halimbawang ito ay naglalarawan ng pagmomodelo ng isang steam reformer. Ang reformation chemistry ay nangyayari sa isang porous catalytic bed kung saan ang enerhiya ay ibinibigay sa pamamagitan ng heating tubes upang himukin ang endothermal reaction system. Ang reactor ay nakapaloob sa ...
Ang mga tubular reactor ay kadalasang ginagamit sa tuluy-tuloy na malakihang produksyon, halimbawa sa industriya ng petrolyo. Ang isang pangunahing parameter ng disenyo ay ang conversion, o ang dami ng reactant na tumutugon upang mabuo ang gustong produkto. Upang makamit ang mataas na conversion, ino-optimize ng mga inhinyero ng proseso ang disenyo ng reaktor: ang haba, lapad at sistema ng pag-init nito. Isang...
Mga yugto ng pagmomodelo
Ang proseso ng parehong teoretikal at eksperimental na pagmomodelo ay binubuo ng mga sumusunod na hakbang:
1. Pagbuo ng isang modelo.
2. Pag-aaral ng modelo.
3. Extrapolation - paglilipat ng nakuhang data sa lugar ng kaalaman tungkol sa orihinal na bagay.
Sa unang yugto, kapag napagtanto ang imposibilidad o hindi naaangkop ng direktang pag-aaral ng bagay, nilikha ang modelo nito. Ang layunin ng yugtong ito ay lumikha ng mga kundisyon para sa ganap na pagpapalit ng orihinal ng isang intermediary object na nagpaparami ng mga kinakailangang parameter nito.
Sa ikalawang yugto, ang modelo mismo ay pinag-aralan - bilang detalyadong kinakailangan upang malutas ang isang tiyak na problema sa pag-iisip. Dito mamamasid ng mananaliksik ang pag-uugali ng modelo, magsagawa ng mga eksperimento dito, sukatin o ilarawan ang mga katangian nito - depende sa mga detalye ng mismong modelo at ang paunang gawaing nagbibigay-malay. Ang layunin ng ikalawang yugto ay upang makuha ang kinakailangang impormasyon tungkol sa modelo.
Ang ikatlong yugto (extrapolation) ay kumakatawan sa isang "pagbabalik" sa orihinal na bagay, i.e. interpretasyon ng nakuhang kaalaman tungkol sa modelo, pagtatasa ng pagiging katanggap-tanggap nito at, nang naaayon, ang aplikasyon nito sa orihinal, na nagpapahintulot, kung matagumpay, upang malutas ang orihinal na problema sa pag-iisip.
Ang mga hakbang na ito ay nagpapatupad ng isang uri ng ikot ng pagmomodelo, kung saan ang modelo at ang orihinal ay magkakaugnay sa isa't isa (Larawan 1).
kanin. 1. Mga yugto ng pagmomodelo
Pagmomodelo sa kimika
Simulation ng mga molekula, mga proseso ng kemikal at mga reaksyon
Ang pagmomodelo ng materyal (pang-eksperimentong) ay malawakang ginagamit sa kimika upang maunawaan at pag-aralan ang istraktura ng mga sangkap at ang mga katangian ng mga reaksiyong kemikal, upang matukoy ang pinakamainam na mga kondisyon para sa mga proseso ng kemikal na teknolohiya, atbp.
Sa biochemistry at pharmacology ang pagmomodelo ay gumaganap ng isang napakahalagang papel. Ang pag-unlad ng pharmacology ay nailalarawan sa pamamagitan ng patuloy na paghahanap at paglikha ng mga bago, mas advanced na mga gamot. Sa mga nagdaang taon, kapag lumilikha ng mga bagong gamot, ang batayan ay hindi ang biologically active substance, tulad ng ginawa dati, ngunit ang substrate kung saan ito nakikipag-ugnayan (receptor, enzyme, atbp.). Ang mga naturang pag-aaral ay nangangailangan ng pinakadetalyadong data sa tatlong-dimensional na istraktura ng mga macromolecule na iyon na pangunahing target para sa gamot. Sa kasalukuyan, mayroong isang bangko ng naturang data, kabilang ang isang malaking bilang ng mga enzyme at nucleic acid. Ang ilang mga kadahilanan ay nag-ambag sa pag-unlad sa direksyon na ito. Una sa lahat, ang pagsusuri ng X-ray diffraction ay napabuti, at ang spectroscopy batay sa nuclear magnetic resonance ay binuo. Ang huling paraan ay nagbukas ng panimula ng mga bagong posibilidad, dahil naging posible na maitatag ang tatlong-dimensional na istraktura ng mga sangkap sa solusyon, i.e. sa isang non-crystalline na estado. Ang isa pang makabuluhang punto ay, sa tulong ng genetic engineering, posible na makakuha ng sapat na dami ng mga substrate para sa detalyadong pag-aaral ng kemikal at physicochemical.
Gamit ang magagamit na data sa mga katangian ng maraming macromolecules, posible na gayahin ang kanilang istraktura gamit ang mga computer. Nagbibigay ito ng isang malinaw na ideya ng geometry hindi lamang ang buong molekula, kundi pati na rin ang mga aktibong sentro nito na nakikipag-ugnayan sa mga ligand. Ang mga tampok ng topograpiya ng ibabaw ng substrate, ang likas na katangian ng mga elemento ng istruktura nito at posibleng mga uri ng interatomic na pakikipag-ugnayan sa mga endogenous na sangkap o xenobiotics ay sinisiyasat. Sa kabilang banda, ang pagmomodelo ng computer ng mga molekula, ang paggamit ng mga graphical system at kaukulang istatistikal na pamamaraan, ay ginagawang posible upang makakuha ng isang medyo kumpletong larawan ng tatlong-dimensional na istraktura ng mga pharmacological substance at ang pamamahagi ng kanilang mga elektronikong larangan. Ang nasabing buod na impormasyon tungkol sa mga physiologically active substance at substrate ay dapat na mapadali ang mahusay na disenyo ng mga potensyal na ligand na may mataas na complementarity at affinity. Hanggang ngayon, ang mga ganitong pagkakataon ay maaari lamang mapanaginipan - ngayon ay nagiging isang katotohanan.
Ang pagmomodelo ng computer ng mga molekula ay batay sa maraming pagtatantya at pagpapalagay. Kaya, ipinapalagay na ang enerhiya ng mga molekula ay tinutukoy lamang ng mga coordinate ng kanilang mga atomo sa espasyo. Ngunit sa katotohanan, ang mga molekula ay hindi nakatigil, at ang mga pagkalkula ng enerhiya sa isang computer ay isinasagawa sa mga static na molekula. Ang mga pamamaraan ng molecular dynamics ay ginagawa na ngayon na ginagawang posible na isaalang-alang ang thermal motion ng mga molekula, ngunit wala pa ring mga diskarte na mapagkakatiwalaan na isinasaalang-alang ang bahagi ng entropy ng enerhiya. Bilang karagdagan, sa loob ng makatwirang oras posible na kalkulahin ang buhay ng system sa pagkakasunud-sunod ng ilang mga picosecond.
Ang pag-aaral ng three-dimensional na istraktura ng mga protina ay nagpapakita ng malaking kahirapan. Sa ngayon, walang mga pamamaraan na tumpak na mahulaan ang tatlong-dimensional na istraktura ng isang protina batay sa pagkakasunud-sunod ng amino acid nito. Kahit na ang paraan ng mga pagkakatulad ay ginagamit, kapag ipinapalagay na ang magkaparehong mga seksyon ng amino acid ng iba't ibang mga protina ay nakasalansan sa katulad na paraan. Ang pang-eksperimentong pagkuha ng mga three-dimensional na imahe ay nauugnay sa maraming kahirapan: Ang pagsusuri ng X-ray diffraction ay nangangailangan ng crystallization ng protina (na posible lamang para sa mga natutunaw na protina), at ang mga kakayahan ng nuclear magnetic resonance ay limitado ng molekular na laki ng mga protina.
Ang papel ng molecular modeling para sa parehong pundamental at inilapat na pananaliksik sa larangan ng molecular biology at biochemistry ay patuloy na lumalaki. Ito ay dahil sa pagpapabuti ng mathematical apparatus, at ang pagtaas sa produktibidad ng teknolohiya ng computer, at ang akumulasyon ng isang malaking halaga ng materyal na katotohanan na nangangailangan ng pagsusuri.
Simulation ng mga kemikal na reaktor ginagamit upang mahulaan ang mga resulta ng mga kemikal na teknolohikal na proseso sa ilalim ng mga ibinigay na kondisyon sa mga aparato ng anumang laki. Ang mga pagtatangka na magsagawa ng isang malakihang paglipat mula sa isang maliit na laki ng reaktor patungo sa isang pang-industriya na reaktor gamit ang pisikal na pagmomolde ay hindi matagumpay dahil sa hindi pagkakatugma ng mga kondisyon para sa pagkakapareho ng kemikal at pisikal na mga bahagi ng proseso (ang impluwensya ng mga pisikal na kadahilanan sa ang rate ng pagbabagong-anyo ng kemikal sa mga reactor na may iba't ibang laki ay makabuluhang naiiba). Samakatuwid, para sa isang malakihang paglipat, ang mga empirikal na pamamaraan ay higit na ginagamit: ang mga proseso ay pinag-aralan sa sunud-sunod na malalaking reaktor (laboratoryo, malakihan, piloto, pilot plant, pang-industriya na reaktor).
Ang pagmomodelo ng matematika ay naging posible na pag-aralan ang reaktor sa kabuuan at magsagawa ng malakihang paglipat. Ang proseso sa isang reaktor ay binubuo ng isang malaking bilang ng mga kemikal at pisikal na pakikipag-ugnayan sa iba't ibang antas ng istruktura - molekula, macroregion, elemento ng reaktor, reaktor. Alinsunod sa mga antas ng istruktura ng proseso, ang isang multi-stage na modelo ng matematika ng reaktor ay binuo. Ang unang antas (ang pagbabagong-anyo ng kemikal mismo) ay tumutugma sa isang kinetic na modelo, ang mga equation na naglalarawan ng pag-asa ng rate ng reaksyon sa konsentrasyon ng mga reactant, temperatura at presyon sa buong saklaw ng kanilang mga pagbabago, na sumasaklaw sa mga praktikal na kondisyon ng proseso. . Ang katangian ng mga sumusunod na antas ng istruktura ay nakasalalay sa uri ng reaktor. Halimbawa, para sa isang reaktor na may nakapirming kama ng katalista, ang pangalawang antas ay isang proseso na nagaganap sa isang butil ng katalista, kapag ang paglipat ng sangkap at paglipat ng init sa porous na butil ay makabuluhan. Kasama sa bawat kasunod na antas ng istruktura ang lahat ng nauna bilang mga bahagi ng bahagi, halimbawa, ang isang matematikal na paglalarawan ng proseso sa isang butil ng katalista ay kinabibilangan ng parehong mga transport at kinetic equation. Kasama rin sa modelong pangatlong antas ang mga equation para sa paglipat ng bagay, init at momentum sa layer ng catalyst, atbp. Ang mga modelo ng iba pang uri ng mga reactor (fluidized bed, uri ng column na may nakasuspinde na catalyst, atbp.) ay mayroon ding hierarchical na istraktura.
Gamit ang matematikal na pagmomodelo, ang pinakamainam na mga kondisyon para sa proseso ay pinili, ang kinakailangang halaga ng katalista, ang laki at hugis ng reaktor, ang parametric na sensitivity ng proseso sa mga kondisyon ng una at hangganan, ang mga lumilipas na kondisyon ay tinutukoy, at ang katatagan ng proseso. pinag-aaralan din. Sa ilang mga kaso, ang teoretikal na pag-optimize ay unang isinasagawa - ang pinakamainam na mga kondisyon ay tinutukoy kung saan ang ani ng kapaki-pakinabang na produkto ay pinakamalaki, hindi alintana kung maisasakatuparan ang mga ito, at pagkatapos, sa pangalawang yugto, ang isang solusyon sa engineering ay pinili na nagbibigay-daan sa pinakamahusay na diskarte sa teoretikal na pinakamainam na rehimen na isinasaalang-alang ang pang-ekonomiya at iba pang mga tagapagpahiwatig. Upang maipatupad ang nahanap na mga mode at normal na operasyon ng reaktor, kinakailangan upang matiyak ang pare-parehong pamamahagi ng pinaghalong reaksyon sa ibabaw ng cross section ng reaktor at kumpletong paghahalo ng mga daloy na naiiba sa komposisyon at temperatura. Ang mga problemang ito ay nalulutas sa pamamagitan ng pisikal (aerohydrodynamic) na pagmomodelo ng napiling disenyo ng reaktor.
Upang pag-aralan ang iba't ibang mga proseso kung saan nangyayari ang mga pagbabagong bahagi at kemikal, pamamaraan ng thermodynamic modeling.
Ang thermodynamic modeling ng phase-chemical transformations ay nakabatay, sa isang banda, sa mga batas at pamamaraan ng chemical thermodynamics, sa kabilang banda, sa mathematical apparatus para sa paglutas ng matinding problema. Ang kumpletong kumbinasyon ng dalawang pamamaraang ito ay ginagawang posible na ipatupad ang isang pamamaraan ng pagkalkula na walang mga pangunahing paghihigpit sa kalikasan at bahagi ng mga sistemang pinag-aaralan.
Upang pag-aralan ang iba't ibang praktikal at teoretikal na mga problema na nauugnay sa mga pagbabagong bahagi at kemikal, kinakailangan na magsagawa ng malalim at detalyadong pag-aaral ng pisikal at kemikal na kakanyahan ng proseso, pagkilala sa mga pattern ng phase at mga pagbabagong kemikal na nagaganap sa prosesong ito, ang impluwensya ng mga parameter ng estado sa kanila at sa ani ng produkto (temperatura, presyon, komposisyon ng pinaghalong reaksyon, atbp.).
Ang pagiging kumplikado ng karamihan sa mga tunay na pisikal at kemikal na proseso ay hindi nagpapahintulot sa mga inilarawang problema na malutas nang eksklusibo sa eksperimentong paraan. Ang pagsusuri ng mga posibleng diskarte ay nagpapakita ng pagiging epektibo ng paggamit ng mga modernong teorya at pamamaraan ng physicochemical at mathematical na pagmomodelo at mga kalkulasyon gamit ang mga termodinamikong konsepto. Gamit ang mga pamamaraang ito, posible na magsagawa ng isang detalyadong pag-aaral ng mga pagbabagong bahagi at kemikal.
Teoretikal na pagmomolde
Ang papel ng teoretikal na pagmomolde sa pag-unlad ng agham ng kemikal ay lalong makabuluhan, dahil ang mundo ng mga atomo at molekula ay nakatago mula sa direktang pagmamasid ng mananaliksik. Samakatuwid, ang cognition ay isinasagawa sa pamamagitan ng pagbuo ng mga modelo ng mga hindi nakikitang bagay batay sa hindi direktang data.
kanin. 2. Pagbuo at pagbabago ng mga modelo
Ang proseso ng theoretical modeling, tulad ng nabanggit sa itaas, ay isinasagawa sa mga yugto: pagbuo ng isang modelo, pag-aaral ng modelo at extrapolation. Sa bawat yugto, matutukoy mo ang ilang partikular na pagkilos na kinakailangan para sa pagpapatupad nito. (Figure 2). Ang mga modelo ay maaaring dagdagan, baguhin at palitan pa ng mga bagong modelo. Ang ganitong mga proseso ay nangyayari kung ang mga mananaliksik ay nakatagpo ng mga bagong katotohanan na sumasalungat sa itinayong modelo. Ang bagong modelo ay resulta ng muling pag-iisip sa mga kontradiksyon ng lumang modelo at bagong nakuhang data.
Isaalang-alang natin ang mga detalye ng proseso ng cognition sa panahon ng teoretikal na pagmomolde.
Ang ideal na pagmomolde ay isa sa mga pamamaraan ng teoretikal na kaalaman. Kaya, ang mga istrukturang bahagi ng teoretikal na kaalaman tulad ng problema, hypothesis at teorya ay dapat maging batayan ng teoretikal na pagmomolde.
Matapos ang akumulasyon ng makatotohanang materyal at ang pagsusuri nito, ang problema ay natukoy at nabuo. Ang problema ay isang anyo ng teoretikal na kaalaman, ang nilalaman nito ay kung ano ang hindi pa alam ng tao, ngunit kung ano ang kailangang malaman. Sa madaling salita, ito ay kaalaman tungkol sa kamangmangan, isang tanong na lumitaw sa kurso ng katalusan at nangangailangan ng sagot. Ang isang problema ay hindi isang nakapirming anyo ng kaalaman, ngunit isang proseso na kinabibilangan ng dalawang pangunahing punto (mga yugto ng paggalaw ng kaalaman) - ang pagbabalangkas at solusyon nito. Ang tamang pag-uuri ng may problemang kaalaman mula sa mga nakaraang katotohanan at paglalahat, ang kakayahang wastong magdulot ng problema ay isang kinakailangang kinakailangan para sa matagumpay na solusyon nito. "Ang pagbabalangkas ng isang problema ay kadalasang mas makabuluhan kaysa sa solusyon nito, na maaari lamang maging isang bagay ng matematika o pang-eksperimentong sining Ang paglalagay ng mga bagong katanungan, ang pagbuo ng mga bagong posibilidad, ang pagsasaalang-alang ng mga lumang problema mula sa isang bagong anggulo ay nangangailangan ng malikhaing imahinasyon. at sumasalamin sa tunay na tagumpay sa agham.”
Nabanggit ni V. Heisenberg na kapag nagpo-pose at nagresolba ng mga problemang pang-agham, ang mga sumusunod ay kinakailangan: a) isang tiyak na sistema ng mga konsepto sa tulong kung saan itatala ng mananaliksik ang ilang mga phenomena; b) isang sistema ng mga pamamaraan na pinili na isinasaalang-alang ang mga layunin ng pananaliksik at ang likas na katangian ng mga problemang nilulutas; c) pag-asa sa mga tradisyong pang-agham, dahil, ayon kay Heisenberg, "sa usapin ng pagpili ng isang problema, ang tradisyon at ang kurso ng pag-unlad ng kasaysayan ay may mahalagang papel," bagaman, siyempre, ang mga interes at hilig ng siyentipiko mismo ay isang tiyak na kahalagahan.
Ayon kay K. Popper, ang agham ay hindi nagsisimula sa mga obserbasyon, ngunit sa mga problema, at ang pag-unlad nito ay isang paglipat mula sa isang problema patungo sa isa pa - mula sa hindi gaanong malalim hanggang sa mas malalim. Ang mga problema ay lumitaw, sa kanyang opinyon, alinman bilang isang resulta ng isang kontradiksyon sa isang partikular na teorya, o kapag ang dalawang magkaibang teorya ay nagbanggaan, o bilang isang resulta ng isang banggaan sa pagitan ng isang teorya at mga obserbasyon.
Kaya, ang isang pang-agham na problema ay ipinahayag sa pagkakaroon ng isang magkasalungat na sitwasyon (lumilitaw sa anyo ng mga magkasalungat na posisyon), na nangangailangan ng naaangkop na paglutas. Ang pagtukoy ng impluwensya sa paraan ng paglalagay at paglutas ng isang problema ay, una, ang likas na katangian ng pag-iisip ng panahon kung saan nabuo ang problema, at, pangalawa, ang antas ng kaalaman tungkol sa mga bagay na may kinalaman sa problemang lumitaw. Ang bawat makasaysayang panahon ay may sariling katangian na mga anyo ng mga sitwasyon ng problema.
Upang malutas ang natukoy na problema, ang siyentipiko ay bumubuo ng isang hypothesis. Ang hypothesis ay isang anyo ng teoretikal na kaalaman na naglalaman ng isang palagay na nabuo batay sa isang bilang ng mga katotohanan, ang tunay na kahulugan nito ay hindi tiyak at nangangailangan ng patunay. Ang hypothetical na kaalaman ay malamang, hindi maaasahan, at nangangailangan ng pagpapatunay at pagbibigay-katwiran. Sa kurso ng pagpapatunay sa mga iniharap na hypotheses, ang ilan sa mga ito ay naging isang tunay na teorya, ang iba ay binago, nilinaw at tinukoy, ang iba ay itinatapon at nagiging mga maling akala kung ang pagsubok ay nagbibigay ng negatibong resulta. Ang pagpapanukala ng bagong hypothesis, bilang panuntunan, ay batay sa mga resulta ng pagsubok sa luma, kahit na negatibo ang mga resultang ito.
Kaya, halimbawa, ang quantum hypothesis na iniharap ni Planck, pagkatapos ng pagsubok, ay naging isang siyentipikong teorya, at ang mga hypotheses tungkol sa pagkakaroon ng "caloric", "phlogiston", "ether", atbp., nang walang paghahanap ng kumpirmasyon, ay pinabulaanan at naging maling akala. Ang bukas na D.I ay pumasa din sa yugto ng hypothesis. Ang pana-panahong batas ni Mendeleev.
DI. Naniniwala si Mendeleev na sa pag-aayos ng isang may layunin, sistematikong pag-aaral ng mga phenomena, walang maaaring palitan ang pagbuo ng mga hypotheses. "Sila," ang isinulat ng mahusay na chemist ng Russia, "ay kinakailangan para sa agham at lalo na sa pag-aaral nito. mas mabuting sumunod sa gayong hypothesis na maaaring maging mas tapat kaysa wala."
Ayon kay Mendeleev, ang hypothesis ay isang kinakailangang elemento ng natural na agham, na kinakailangang kasama ang: a) koleksyon, paglalarawan, sistematisasyon at pag-aaral ng mga katotohanan; b) pagbuo ng hypothesis o palagay tungkol sa sanhi ng relasyon ng mga phenomena; c) eksperimental na pagsubok ng mga lohikal na kahihinatnan mula sa mga hypotheses; d) gawing maaasahang teorya ang mga hypothesis o itapon ang dating tinanggap na hypothesis at maglagay ng bago. DI. Malinaw na naunawaan ni Mendeleev na walang hypothesis na walang maaasahang teorya: "Sa pamamagitan ng pagmamasid, paglalarawan at paglalarawan kung ano ang nakikita at napapailalim sa direktang pagmamasid - sa tulong ng mga pandama, maaari nating, kapag nag-aaral, umaasa na ang mga unang hypotheses ay lilitaw, at pagkatapos ay ang mga teorya ng kung ano ang nangyayari ngayon upang maging batayan ng kung ano ang pinag-aaralan."
Kaya, ang isang hypothesis ay maaaring umiral lamang hangga't hindi ito sumasalungat sa mga mapagkakatiwalaang katotohanan ng karanasan, kung hindi, ito ay magiging isang kathang-isip lamang. Ito ay sinusuri (napatunayan) ng mga nauugnay na eksperimentong katotohanan (lalo na ang eksperimento), upang makuha ang katangian ng katotohanan. Ang isang hypothesis ay mabunga kung ito ay maaaring humantong sa bagong kaalaman at mga bagong pamamaraan ng katalusan, sa isang paliwanag ng isang malawak na hanay ng mga phenomena.
Ang isang hypothesis bilang isang paraan ng pagbuo ng siyentipiko at teoretikal na kaalaman sa aplikasyon nito ay dumadaan sa mga sumusunod na pangunahing yugto.
1. Isang pagtatangka na ipaliwanag ang kababalaghang pinag-aaralan batay sa mga kilalang katotohanan at batas at teoryang umiiral na sa agham. Kung nabigo ang pagtatangka na ito, pagkatapos ay isang karagdagang hakbang ang gagawin.
2. Paggawa ng mga haka-haka, pagpapalagay tungkol sa mga sanhi at pattern ng isang naibigay na kababalaghan, mga katangian nito, koneksyon at relasyon, paglitaw at pag-unlad nito, atbp. Sa yugtong ito ng pag-unawa, ang panukalang iniharap ay kumakatawan sa malamang na kaalaman, hindi pa napatunayan nang lohikal at hindi masyadong nakumpirma ng karanasan upang maituring na maaasahan. Kadalasan, maraming mga pagpapalagay ang inilalagay upang ipaliwanag ang parehong kababalaghan.
3. Pagtatasa sa bisa at bisa ng mga hypothesis na iniharap at pagpili ng pinaka-malamang mula sa kanila batay sa mga nabanggit na kondisyon para sa bisa ng hypothesis.
4. Pag-deploy ng iniharap na palagay sa isang integral na sistema ng kaalaman at deduktibong derivation ng mga kahihinatnan mula dito para sa layunin ng kanilang kasunod na empirical verification.
5. Nakaranas, pang-eksperimentong pagpapatunay ng mga kahihinatnan na iniharap mula sa hypothesis. Bilang resulta ng pagpapatunay na ito, ang hypothesis ay maaaring "naging ranggo" ng isang siyentipikong teorya, o pinabulaanan, "umalis sa eksenang siyentipiko." Gayunpaman, dapat tandaan na ang empirikal na pagkumpirma ng mga kahihinatnan ng isang hypothesis ay hindi ganap na ginagarantiyahan ang katotohanan nito, at ang pagtanggi sa isa sa mga kahihinatnan ay hindi malinaw na nagpapahiwatig ng kasinungalingan nito sa kabuuan. Ang sitwasyong ito ay partikular na katangian ng mga rebolusyong pang-agham, kapag ang mga pangunahing konsepto at pamamaraan ay radikal na nagambala at sa panimula ay may mga bagong ideya na lumitaw.
Kaya, ang mapagpasyang pagsubok ng katotohanan ng isang hypothesis ay sa huli ay pagsasagawa sa lahat ng mga anyo nito, ngunit ang lohikal (teoretikal) na pamantayan ng katotohanan ay gumaganap din ng isang tiyak (pantulong) na papel sa pagpapatunay o pabulaanan ng hypothetical na kaalaman. Ang isang nasubok at napatunayang hypothesis ay nagiging isang maaasahang katotohanan at nagiging isang siyentipikong teorya.
Iba't ibang mga diskarte para sa pagbuo ng mga kinetic na modelo ng mga kumplikadong reaksyon
Ang mga kemikal na kinetika ay ang agham ng mga rate ng mga reaksiyong kemikal, ang pabago-bagong pag-uugali ng isang sistema ng reaksyon sa landas nito patungo sa ekwilibriyong kemikal. Ang lugar na ito ng pisikal na kimika ay malapit na nauugnay sa pag-aaral ng mga mekanismo ng mga reaksiyong kemikal, dahil ang mga kinetika ng kemikal ay isa sa mga pamamaraan para sa pag-aaral ng mga mekanismo, at ang mekanismo ng reaksyon, na naging malinaw na ngayon, ay ang batayan para sa pagbuo ng isang sapat na kinetic model.
Ang ika-20 siglo ay natapos na - isang siglo ng matagumpay na pag-unlad ng mga kemikal na kinetika, kabilang ang parehong antas ng micro ng isang elementarya at ang antas ng macro ng mga proseso ng multi-stage na nailalarawan sa pamamagitan ng kamangha-manghang pagiging kumplikado ng mga mekanismo. Ang mga pundasyon ng kinetika ng kemikal bilang isang agham ay inilatag sa simula ng siglo ng mga gawa ng mga nagwagi ng Nobel na sina J. Van't Hoff (1901), S. Arrhenius (1903), W. Ostwald (1909), gayundin ni M Bodenstein. Ang iba't ibang aspeto ng teorya ng isang elementarya ay binuo ni G. Eyring, M. Polyani, V. G. Levich at R. R. Dogonadze, mga nanalo ng Nobel Prize na sina K. Fukui at R. Hoffman (1981), G. Taube (1983), R. Marcus (1992) at marami pang ibang mananaliksik. Ang teorya ng chain reactions ay nilikha ng mga gawa ni M. Bodenstein, J. Christiansen at Nobel laureates N.N.N.Hinshelwood at S.N.
Ang mga Nobel Prize ay iginawad sa mga pamamaraan at resulta ng pananaliksik sa mabilis na mga reaksyon sa elementarya (M. Eigen, J. Porter, R. Norrish, 1967), pati na rin ang pagbuo ng mga pamamaraan para sa pag-aaral ng dinamika ng mga elementarya na pagkilos ng mga reaksyon ng gas-phase ( D. Herschbach, Ya Li, J. Polyani, 1986).
Ang mga natitirang resulta ay nakuha sa larangan ng kinetics ng homogenous at heterogenous catalytic reactions. Pansinin na lang natin ang teorya
kinetics ng mga heterogenous na reaksyon sa hindi magkakatulad na mga ibabaw (M.I. Temkin at S.Z. Roginsky), ang teorya ng kinetics ng mga nakatigil na reaksyon ng Horiuchi-Temkin, pagtuklas ng catalysis ng oxidative transformations ng olefins sa pamamagitan ng palladium complexes (I.I. Moiseev, M.N. Vargaftik, Yargaftik, Ya. , Yu. Smidt, atbp.) at ang paglikha ni I.I Moiseev ng teorya ng mga prosesong ito batay sa mga detalyadong kinetic na pag-aaral (A.P. Karpinsky Prize, 1999).
Ang ikadalawampu siglo ay nakoronahan ng kahanga-hangang pagtuklas ng isang bagong larangan ng pisikal na kimika ng elementarya, na tinatawag na "femtochemistry," at ang 1999 Nobel Prize sa Chemistry sa American scientist, Egyptian A. Zewail "para sa kanyang pag-aaral ng mga estado ng paglipat ng ang femtosecond method (10–15 sec) laser spectroscopy". Naabot na ang limitasyon para sa pagsukat ng mga rate ng mga reaksiyong kemikal. Naging posible na subaybayan ang mga prosesong nagaganap sa isang panginginig ng boses ng mga atom sa isang kemikal na bono - 10 - 100 fs. Ang estado ng paglipat ng isang bilang ng mga reaksyon ay naitala na may isang resolusyon na 0.1 Å kasama ang coordinate ng reaksyon na may isang buong parang multo na larawan. Ang antas ng resolusyon ng mga katabing estado ng enerhiya na ~10–4 cm–1 ay nakamit.
Ang lahat ng mga resulta ng pag-aaral ng "nonequilibrium" kinetics ng mga reaksiyong kemikal sa microlevel ay napakahalaga para sa pagpapatunay ng mga pangunahing prinsipyo ng kinetics ng kemikal, ngunit sa ngayon ay hindi gaanong ginagamit para sa paglutas ng mga problema sa antas ng macro - pag-aaral ng mga mekanismo ng mga kumplikadong reaksyon sa mga gas, mga solusyon. at sa ibabaw ng isang solid sa ilalim ng mga kondisyon ng pamamahagi ng Maxwell-Boltzmann, i.e. .e. mga problema ng "equilibrium" kinetics ng mga reaksiyong kemikal. Kung ang problema sa pagpapaliwanag ng mga mekanismo at pagbuo ng mga kinetic na modelo ng mga kumplikadong reaksyon para sa "equilibrium" kinetics ng gas-phase radical chain reactions ay praktikal na nalutas (dahil sa posibilidad ng pagbuo ng maximum na mga mekanismo o mga network ng reaksyon na may kilalang rate constants ng elementary stages), pagkatapos ay para sa mga kumplikadong proseso ng multi-ruta sa mga solusyon at sa ibabaw ang solusyon ay ang gawaing ito ay nagsisimula pa lamang. Ito ay isang problema sa ika-21 siglo.
Mayroong tatlong uri ng mga modelo ng matematika (mga paglalarawang matematika) ng mga kumplikadong proseso. Ang mga stochastic na modelo ay gumagamit ng mga probabilistikong ideya tungkol sa mga proseso sa object ng pag-aaral. Ang mga function ng pamamahagi ng probabilidad ay kinakalkula para sa mga variable na parameter ng modelo (konsentrasyon, temperatura sa kaso ng mga proseso ng kemikal). Ang mga modelong ito ay bihirang ginagamit pa rin sa mga kemikal na kinetika, ngunit napatunayang kapaki-pakinabang ang mga ito para sa paglalarawan at pagmomodelo ng pag-uugali ng malalaking sistema (mga kemikal na kumplikado, mga kemikal na halaman). Ginagamit ang mga istatistikal na modelo upang ilarawan ang isang eksperimento sa isang gumaganang bagay sa pananaliksik. Ang ugnayan sa pagitan ng mga halaga ng mga variable na pumapasok at lumalabas sa system ay inilarawan nang hindi gumagamit ng pisikal at kemikal na impormasyon tungkol sa mga prosesong nagaganap sa bagay (modelo ng black box). Ang mga matematikal na paglalarawan ng pag-uugali ng system ay karaniwang mga equation sa anyo ng mga polynomial. Upang matiyak ang istatistikal na kalayaan ng mga parameter ng modelo, ginagamit ang pang-eksperimentong disenyo (halimbawa, mga orthogonal na eksperimentong disenyo). Ang mga deterministikong modelo ay batay sa mga batas ng pisikal at kemikal na mga proseso na may partikular na istraktura ng modelo. Ang mga modelong kinetiko na batay sa teorya ay tiyak na mga naturang modelo. Ang kursong ito ng mga lektura ay ilalaan sa mga deterministiko, istruktura, batay sa teoryang kinetic na mga modelo (KM) ng mga prosesong kemikal.
Sa pagmomodelo ng matematika ng proseso ng catalytic, mayroong isang tiyak na hierarchy ng mga modelo ng matematika. Ang mga modelo ng unang antas ay mga kinetic na modelo ng mga proseso sa butil ng solid catalyst o sa elementary volume ng liquid phase sa isang homogenous na reaksyon, hindi kumplikado ng mga proseso ng mass transfer, init at hydrodynamic na mga kadahilanan. Isinasaalang-alang ng mga pangalawang antas na modelo sa heterogenous catalysis ang mga proseso sa catalyst layer, at ang mga third-level na modelo sa homogenous at heterogenous catalysis ay mga modelo ng reactor sa kabuuan, kabilang ang lahat ng proseso ng paglipat at istraktura ng daloy. Isasaalang-alang ang mga first level models (LM) sa kursong ito ng mga lecture. Ang ganitong mga modelo ay kinakailangan upang pag-aralan ang mga bagong reaksyon, upang ma-optimize ang mga proseso ng catalytic, upang makalkula ang mga pang-industriyang reactor (bilang mga bahagi ng isang modelo ng matematika ng isang reaktor), upang lumikha ng mga awtomatikong sistema ng kontrol sa proseso.
Tungkol sa konsepto ng "mekanismo ng reaksyon"
Kaya, ang batayan para sa pagbuo ng isang CM ay ang mekanismo ng proseso, i.e. isang hanay ng mga elementarya na yugto na humahantong sa pagbabagong-anyo ng mga paunang reagent sa mga produktong panghuling reaksyon, at para sa parehong reaksyon (catalytic o non-catalytic) mayroong isang tiyak na hanay ng mga mekanismo na tinutukoy ng kasalukuyang katawan ng kaalaman at mga paradigm na gumagana sa kimika .
Halimbawa, para sa nucleophilic substitution reaction sa aromatic ring ng ArX (non-catalytic, catalyzed ng mga metal complex o sapilitan ng paglipat ng electron mula at papunta sa ArX), 8 mekanismo ang naitatag:



13 isang ruta at 80 dalawang-ruta na mekanismo para sa simpleng reaksyon ng ethylene hydrogenation sa mga metal catalyst ay iminungkahi. Sa madaling salita, para sa bawat sistema ng reaksyon (reagents, catalyst) mayroong isang tiyak na hanay ng mga elementarya na yugto - isang network ng reaksyon (maximum na mekanismo), ang mga indibidwal na bloke na kung saan ay ipinatupad depende sa likas na katangian ng katalista, mga kondisyon, mga substituent sa substrate, at ang antas ng oksihenasyon ng metal catalyst.
Sa pagtatapos ng siglo, nagkaroon ng pagkakaisa ng physicochemical at pormal na kinetic approach sa pag-aaral ng mga mekanismo. Ang isang pananaw ay nabuo sa mekanismo bilang ang pagkakaisa ng dalawang bahagi ng konseptong ito - ang topological (istruktura) at mga sangkap ng kemikal, at sa kanilang pagkakapantay-pantay - imposibleng malinaw na maitatag ang istraktura ng mekanismo (ang relasyon ng mga elementarya na yugto). sa batayan lamang ng isang pormal na kinetic na paglalarawan, ang tinatawag na "mechanism diagram" , at pagkatapos ay punan ito ng kemikal na nilalaman. Sa pangkalahatang kaso, imposibleng makuha mula sa kinetic na mga eksperimento ang impormasyong kinakailangan para sa tamang pagkakakilanlan ng diagram ng mekanismo nang hindi tinukoy ang mekanismong ito at nang hindi nagtatakda ng mga kaukulang problema para sa pormal na pamamaraan ng kinetic.
Ang lahat ng mga pangyayaring ito ay nangangailangan ng rebisyon ng tradisyonal na diskarte para sa pagbuo ng CM.
Mga alternatibong estratehiya para sa pagbuo ng CM
Kasama sa tradisyonal na pamamaraan para sa pagbuo ng CM ang mga sumusunod na hakbang:
Ang pangunahing kawalan ng pamamaraang ito (diskarte) ay ang kakulangan ng mga algorithm para sa hindi malabo na pagsasagawa ng lahat ng mga yugto. Dahil ang isang eksperimento ay maaaring sapat na inilarawan ng isang malaking bilang ng mga mathematical na modelo (equation), ang mananaliksik ay dapat magkaroon ng ilang hypothesis tungkol sa disenyo ng mekanismo (tungkol sa istruktura ng mekanismo) o tungkol sa anyo ng mga iminungkahing equation. Sa kasong ito, ang pagpili ng mga posibleng hypotheses (kung minsan ay intuitive) ay nangyayari pagkatapos maisagawa ang eksperimento. Walang algorithm para sa paglipat mula sa isang mathematical na modelo patungo sa isang pisikal na modelo (lalo na para sa mga multi-ruta na reaksyon) (hakbang (b)). Ang paglipat sa mekanismo ng reaksyon (hakbang (c)) ay arbitrary din at hindi pormal. Sa lahat ng mga yugto ng diskarteng ito, mayroong likas na pagnanais na makakuha ng hindi bababa sa isang equation (at "diagram ng mekanismo") na hindi sumasalungat sa eksperimento, at, kadalasan, walang pag-uusap tungkol sa anumang diskriminasyon ng isang hanay ng mga hypotheses. Sa kabaligtaran, ang mga may-akda ng gayong pamamaraan ng mekanismo ay nagsimulang magsagawa ng mga eksperimento upang patunayan ang mekanismo na tila sa may-akda ang pinaka-makatwiran. Kasabay nito, matagal nang itinatag na imposibleng patunayan ang anumang hypothesis. Posibleng ipakita na itapon ang mga hindi gumaganang hypotheses at magpakita ng kasunduan sa eksperimento ng mga natitirang hypotheses - ang hanay ng mga working hypotheses. Ang pagiging posible ng paglalagay ng isang hanay ng mga hypotheses at pagkuha ng maraming gumaganang hypotheses ay kapani-paniwalang nabigyang-katwiran mahigit 100 taon na ang nakalilipas ng American geologist na si T. Chamberlain.
Kaya, ang isang makatwirang diskarte para sa pagbuo ng isang CM ay isang malinaw na pamamaraan na makatwiran sa hypothetico-deductive na lohikal na pamamaraan ng pananaliksik, na sinusuportahan ng mga kakayahan ng mga computer at epektibong software. Ang kakanyahan ng diskarte na ito ay makikita sa pagkakasunud-sunod ng mga yugto nito:

Maaaring kabilang sa diskriminasyon ng mga hypotheses ang diskriminasyon sa mga yugto, mga bloke ng mga yugto, mga indibidwal na mekanismo, at mga node ng interface sa mga reaksyong multi-ruta.
Ang uri ng CM (form ng mathematical na paglalarawan) ay nakasalalay sa mga katangian ng mekanismo (linear o nonlinear), ang mga kondisyon ng proseso (nakatigil, parang nakatigil, hindi nakatigil), ang uri ng reaktor (bukas, sarado) at isang bilang ng mga tinatanggap na pagpapalagay. Ang linear na mekanismo ay isang mekanismo na ang mga elementarya na yugto sa pasulong at pabalik na direksyon ay linear sa mga intermediate—isang intermediate lamang ang matatagpuan sa kaliwa (o kanan) ng arrow sa elementarya na yugto. Kung higit sa isang intermediate ang kasangkot sa isang yugto (kabilang ang 2 molekula ng isang intermediate), ang mga yugto ay nonlinear at ang mekanismo ay nonlinear.
Ang pinaka-pangkalahatang uri ng quantum mechanics ay mga sistema ng differential equation, algebraic-differential o algebraic equation
![]() , (1)
, (1)
ang kanang bahagi kung saan ay palaging produkto ng matrix ng stoichiometric coefficients para sa mga yugto ng mekanismo (transposed) ng column vector ng mga bilis ng elementary stages ( ![]() ). Sa kaso ng mga linear na mekanismo para sa mga reaksyon sa ilalim ng nakatigil o parang nakatigil na mga kondisyon, ang kanang bahagi ng equation (1) ay binago sa fractional rational equation ng mga rate para sa mga reactant (R i) o mga rate para sa mga ruta (R p). Ang mga sistema ng algebraic equation para sa mga nonlinear na mekanismo ay karaniwang hindi nalulutas, at ang mga equation ng uri (1) ay hindi binabawasan sa isang mas simpleng fractional-rational form.
). Sa kaso ng mga linear na mekanismo para sa mga reaksyon sa ilalim ng nakatigil o parang nakatigil na mga kondisyon, ang kanang bahagi ng equation (1) ay binago sa fractional rational equation ng mga rate para sa mga reactant (R i) o mga rate para sa mga ruta (R p). Ang mga sistema ng algebraic equation para sa mga nonlinear na mekanismo ay karaniwang hindi nalulutas, at ang mga equation ng uri (1) ay hindi binabawasan sa isang mas simpleng fractional-rational form.
Sa kaso ng mga kinetics sa hindi magkakatulad na mga ibabaw sa ilalim ng nakatigil na mga kondisyon, ang rate ay maaari ding ilarawan sa pamamagitan ng isang power equation ng uri (2) (M.I. Temkin's equation para sa ammonia synthesis):
 (2)
(2)
Coefficient m = 0.5 sa kaso ng isang iron catalyst, k + /k – = K – reaction equilibrium constant
Ang mga tampok ng mga kinetic na modelo para sa iba't ibang mga kaso, mga pamamaraan para sa pagkuha ng mga kinetic equation at mga pamamaraan para sa pagbuo ng CM sa loob ng balangkas ng isang makatuwirang diskarte ay tatalakayin sa mga susunod na seksyon ng kurso. Ang pag-master ng tradisyonal na diskarte ay ang paksa ng araling-bahay (course work).
Mga tanong para sa pagpipigil sa sarili
1) Ilista ang mga disadvantage ng tradisyonal na diskarte.
2) Metodolohikal na pagbibigay-katwiran para sa isang makatwirang diskarte.
3) Pangalanan ang mga pangunahing yugto ng isang makatuwirang diskarte at ilista ang mga pakinabang ng diskarteng ito sa lahat ng mga yugto ng pagbuo ng isang CM.
4) Pangalanan ang mga tampok ng CM sa kaso ng mga linear at nonlinear na mekanismo.
Literatura para sa malalim na pag-aaral ng paksa
1. Schmid R., Sapunov V.N., Impormal na kinetics, M., Mir, 1985, 263 pp. (tradisyonal na diskarte).
2. Brook L.G., Zeigarnik A.V., Temkin O.N., Valdez-Perez R., Mga pamamaraan para sa pagbuo ng mga hypotheses tungkol sa mga mekanismo ng reaksyon. Teksbuk, M.: MITHT, 1999.
3. Temkin O.N., Brook L.G., Zeigarnik A.V., Ilang aspeto ng diskarte sa pag-aaral ng mga mekanismo at pagbuo ng mga kinetic na modelo ng mga kumplikadong reaksyon, Kinetics at Catalysis, 1993, v. 34, blg. 445 – 462.
4. Temkin O.N., Mga problema sa kinetika ng mga kumplikadong reaksyon, Ross. chemical journal, 2000, v. 44, blg. 58 – 65.




At catalysis ng Kagawaran ng Chemistry at Teknolohiya ng Basic Organic Synthesis ng Moscow Institute of Chemical Technology. M.V. Lomonosov. Upang isulong ang mga hypotheses tungkol sa mga mekanismo ng synthesis ng acrylic acid ayon sa reaksyon (6) sa mga solusyon ng palladium complexes, ginamit ang 11 pagbabagong-anyo: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Gamit ang programa ng ChemNet, nakuha ang reaksyon ..
Hindi bababa sa, ang isang synergetic na istilo ng pag-iisip ay maaaring maging isang uri ng plataporma para sa isang bukas na malikhaing pag-uusap sa pagitan ng mga siyentipiko, palaisip, artista na may iba't ibang malikhaing saloobin at pananaw sa mundo. 2. Ilang kabalintunaan na kahihinatnan ng synergetics Maraming mga bagong kabalintunaan na ideya, imahe at konsepto ang lumitaw sa synergetics. Bilang karagdagan, mula sa isang synergetic na pananaw, maaaring...





... ; VCH3OH=10ml; 0: 0: 0 = 5:3:2. Ang mga dahilan para sa epekto na ito ay galugarin sa mga karagdagang pag-aaral. 5. Patent search 5.1. Panimula Ang tesis na ito ay nakatuon sa pag-aaral ng mga kondisyon para sa paglitaw ng isang vibrational mode sa panahon ng oxidative carbonylation ng mga alkynes sa pagkakaroon ng mga catalyst ng palladium. Ang prosesong ito ay may malaking interes, dahil sa hinaharap ay papayagan nito...





Upang mabuhay sa isang mapagkumpitensyang kapaligiran at matagumpay na umunlad sa merkado, ang isang negosyo ay nangangailangan ng isang malinaw na binuo na plano kapwa para sa pangmatagalan at para sa kasalukuyang panahon. KABANATA 2. PAGSUSURI NG POSISYON NG ENTERPRISE LLC "AVTODOM-ATEKS" SA PAMILIHAN NG MGA SERBISYONG SERBISYO NG KOTSE 2.1 Maikling teknikal at pang-ekonomiyang katangian ng negosyo Ang enterprise na "Avtodom-Atex" ay itinatag batay sa desisyon ng mga kalahok na may petsang 23 ...
Layunin ng trabaho
- 1. Pamilyar ang iyong sarili sa mga pamamaraan para sa pagbuo ng mga kinetic na modelo ng magkakaibang mga reaksiyong kemikal.
- 2. Lumikha ng isang kinetic na modelo ng isang heterogenous na kemikal na reaksyon alinsunod sa isang ibinigay na mekanismo.
- 3. Pumili ng isang numerical na paraan at bumuo ng isang programa sa pagkalkula.
- 4. Siyasatin ang dinamika ng mga pagbabago sa mga konsentrasyon ng mga reactant ng reaksyon at mga intermediate compound.
Kinetics ng heterogenous na mga reaksiyong kemikal
Ang mga pundasyon ng heterogenous chemical kinetics ay inilatag sa mga gawa ng Langmuir, Temkin at iba pa. Sa mga gawaing ito, ang konsepto ng isang perpektong adsorbed layer ay nabuo, batay sa isang pagkakatulad sa mga konsepto ng homogenous na kinetics. Ginagamit ng modelong ito ang mga sumusunod na pagpapalagay:
- 1) ang pagkakapareho ng lahat ng mga lugar ng ibabaw ng katalista at ang kalayaan ng enerhiya ng chemisorption mula sa antas ng pagpuno sa ibabaw na may iba't ibang mga adsorbents;
- 2) ang immutability ng katalista at ang kalayaan ng mga katangian nito mula sa komposisyon ng pinaghalong reaksyon at ang epekto nito sa katalista;
- 3) balanseng pamamahagi ng enerhiya.
Ang isang pormal na analogue ng kinetic law ng mass action para sa elementarya na mga proseso sa solid surface ay ang law of effective surfaces (LAS).
Ayon sa orihinal na pormulasyon nito, ang rate ng isang kemikal na reaksyon ay proporsyonal sa produkto ng mga konsentrasyon sa ibabaw ng mga tumutugon na sangkap sa mga kapangyarihan na katumbas ng mga stoichiometric ratio kung saan sila nakikipag-ugnayan (1.38).
Hayaang maganap ang isang pangunahing reaksiyong kemikal
Sa kasong ito, ang lahat ng mga sangkap ay nakikipag-ugnayan mula sa adsorbed na estado. Tukuyin natin ang zi bilang ang bahagi ng ibabaw na inookupahan ng i-th adsorbed substance. Pagkatapos, alinsunod sa batas ng kumikilos na mga ibabaw, ang rate ng hindi maibabalik na reaksyon (1.38) ay maaaring isulat bilang

kung saan ang W ay ang rate ng reaksyong kemikal;
k - pare-pareho ang rate; ay ang fraction ng ibabaw na inookupahan ng i-th adsorbed particle; - bahagi ng libreng ibabaw; i - stoichiometric coefficients ng mga yugto;
Ang pagbabago sa bilang ng mga moles sa panahon ng isang kemikal na reaksyon.
Kung hindi lahat ng mga sangkap ay nakikipag-ugnayan mula sa adsorbed state, ngunit direktang tumutugon mula sa gas phase, kung gayon sa isang mas pangkalahatang anyo ang expression para sa batas ng kumikilos na mga ibabaw ay nakasulat tulad ng sumusunod:

nasaan ang mga bahagyang presyon (konsentrasyon) ng mga sangkap na tumutugon mula sa bahagi ng gas; - stoichiometric coefficients;
n, m - ang dami ng mga sangkap na na-adsorbed sa ibabaw ng catalyst at tumutugon mula sa gas phase.
Halimbawa: hayaan ang hydrogen adsorption na mangyari sa aktibong site ng catalyst Z na may pagbuo ng isang adsorbed surface compound ZH2:
pagkatapos, batay sa ZDP, ang rate ng elementarya na reaksyong kemikal na ito ay maaaring isulat bilang
Sa una, ang kadahilanan ng pag-aalis, ang "labanan" ng mga bahagi ng pinaghalong reaksyon para sa mga lugar sa ibabaw ng katalista, ay itinuturing na pangunahing kadahilanan sa pagtukoy ng mga kinetic dependences. Sa kasong ito, isang karagdagang pagpapalagay ang ginawa tungkol sa mataas na rate ng mga yugto ng adsorption at desorption kumpara sa mga pagbabagong kemikal mismo. Ang mga kasunod na pag-aaral ay nagpakita ng mga makabuluhang limitasyon sa mga pagpapalagay na ito. Gayunpaman, ang Hinshelwood, Schwab, Hougen, Watson at iba pa, batay sa kanila, ay nakakuha ng mga equation na kasiya-siyang naglalarawan sa kinetic na eksperimento sa isang tiyak na hanay ng mga pagbabago sa parameter. Karaniwang kinetic equation formula

kung saan ang k ay ang rate constant;
Ang Ci ay ang konsentrasyon ng i-th reagent sa gaseous medium;
Equilibrium constant ng adsorption stage ng i-th component;
i ay ang stoichiometric coefficient.
Ang pinaka-pangkalahatang paglalarawan ng mga kinetika ng mga kumplikadong reaksyon ay ibinibigay sa teorya ng Horiuchi-Temkin ng mga nakatigil na reaksyon.
Ipinakilala ni Juro Horiuchi ang mga sumusunod na konsepto: mga independiyenteng intermediate, stoichiometric number, ruta ng reaksyon, independiyenteng mga ruta ng reaksyon.
Ang mga stoichiometric na numero ay mga numero na pinili upang pagkatapos na i-multiply ang mga kemikal na equation ng bawat yugto sa naaangkop na stoichiometric na numero at pagkatapos ay idagdag ang mga equation, lahat ng intermediate substance ay kanselahin. Ang resultang equation ay tinatawag na gross equation. Ang bawat hanay ng mga stoichiometric na numero na humahantong sa pag-aalis ng mga intermediate ay tinatawag na ruta ng reaksyon.
Sa teorya ng mga nakatigil na reaksyon, ipinakilala ang mga konsepto ng "stage run," "ruta run," at "reaksyon bilis kasama ang pangunahing ruta". Ang bilang ng mga yugto ng isang yugto ay nauunawaan bilang pagkakaiba sa bilang ng mga pagkilos ng isang elementarya na reaksyon sa pasulong at pabalik na direksyon. Kung gayon ang rate ng isang simpleng reaksyon ay katumbas ng bilang ng mga pagtakbo nito sa bawat yunit ng oras sa isang puwang ng reaksyon ng yunit. Ang isang pagtakbo sa isang ruta ay nangangahulugan na kasing dami ng mga pagtakbo ng bawat yugto ang naganap bilang stoichiometric number nito para sa isang partikular na ruta. Sa kaso kapag ang pagbuo ng isang molekula ng isang intermediate na sangkap sa isa sa mga yugto ay nabayaran ng pagkonsumo ng molekula na ito sa isa pang yugto, ang isang nakatigil na mode ng reaksyon ay natanto. Kung sa yugtong ito ay hindi nabuo ang pangwakas na produkto, ngunit isang bagong intermediate substance, dapat din itong kainin sa ibang yugto. Ang buong kabayaran para sa pagbuo at pagkonsumo ng mga intermediate substance ay nangangahulugan ng pagkumpleto ng isang run sa alinman sa mga ruta.
Kaya, ang bilis ng isang nakatigil na reaksyon ay tinutukoy ng mga indibidwal na pagtakbo sa lahat ng posibleng ruta. Bilang resulta, ang lahat ng yugto ng pagtakbo para sa isang partikular na oras ay natatanging matutukoy sa pamamagitan ng mga pangunahing ruta. Ang rate ng reaksyon sa base na ruta ay ang bilang ng mga run sa base na ruta bawat yunit ng oras sa isang unit reaction space, sa kondisyon na ang lahat ng mga run ng mga yugto ay ibinahagi sa mga ruta ng isang partikular na batayan. Ang rate ng reaksyon sa kabuuan ay tinutukoy ng mga bilis sa mga pangunahing ruta.
Ang kondisyon ng pagkatigil para sa mga elementarya na yugto ng mga reaksiyong kemikal ay maaaring isulat tulad ng sumusunod:
nasaan ang mga bilis ng elementarya na yugto (sth, forward at reverse); - bilis sa ruta P;
Stoichiometric coefficient ng sth stage, ruta P.
Batay sa equation (1.44), nakakakuha tayo ng equation na tinatawag na equation of stationary reactions:

kung saan, ... - bilis kasama ang mga ruta;
Mga bilis ng elementarya na yugto sa pasulong at pabalik na direksyon;
Stoichiometric coefficient ng i-th stage kasama ang j-th na ruta.
Gamit ang equation na ito, mas madaling makuha ang mga kinetic equation para sa mga heterogenous na reaksyong kemikal sa tahasang anyo - para sa mga linear na mekanismo at, sa ilang mga kaso, para sa mga nonlinear.
Panimula
Sa madaling sabi, ang esensya ng mga problemang ipinakita sa papel na ito ay ang mga sumusunod. Ang pagbuo ng kimika ay malapit na nauugnay sa pagbuo ng mga modelo ng matematika. Masasabi nating isa ito sa pinakakaraniwan at masinsinang impormasyon na paraan ng quantitative presentation ng experimental data. Ang isang pormula o ang halaga ng koepisyent sa loob nito ay maaaring mahusay na kumatawan sa mga resulta ng maraming mga eksperimento.
Ang mga layunin ng pagmomodelo sa kimika ay naiiba, mula sa pagtatayo ng mga empirikal na relasyon nang walang mga paghihigpit sa mga parameter at sa dami ng pag-verify ng mga teoretikal na posisyon, kung saan ang parehong anyo ng modelo at ang mga halaga ng mga parameter nito ay dapat na tumutugma sa physicochemical na kahulugan ng mga probisyong ito.
Ang aming trabaho ay nagtatakda ng mga sumusunod na gawain:
- isaalang-alang ang mga pangunahing kaalaman ng kinetika ng mga reaksiyong kemikal gamit ang halimbawa ng homogenous
- mga halimbawa ng pagmomodelo ng kinetic equation gamit ang halimbawa ng homogenous na reaksyon
- isaalang-alang ang numerical na paraan ng Euler
- galugarin ang matematikal na modelo ng paglitaw ng mga homogenous na reaksyon
- pag-aralan ang mga uri ng mga modelo ng mga kumplikadong reaksyon
1 Kasaysayan ng kinetika ng kemikal
Ang mga kemikal na kinetika ay ang agham ng mga rate ng mga reaksiyong kemikal, ang pabago-bagong pag-uugali ng isang sistema ng reaksyon sa landas nito patungo sa ekwilibriyong kemikal. Ang lugar na ito ng pisikal na kimika ay malapit na nauugnay sa pag-aaral ng mga mekanismo ng mga reaksiyong kemikal, dahil ang mga kinetika ng kemikal ay isa sa mga pamamaraan para sa pag-aaral ng mga mekanismo, at ang mekanismo ng reaksyon, na naging malinaw na ngayon, ay ang batayan para sa pagbuo ng isang sapat na kinetic model.
Ang ika-20 siglo ay natapos na - isang siglo ng matagumpay na pag-unlad ng mga kemikal na kinetika, kabilang ang parehong antas ng micro ng isang elementarya at ang antas ng macro ng mga proseso ng multi-stage na nailalarawan sa pamamagitan ng kamangha-manghang pagiging kumplikado ng mga mekanismo. Ang mga pundasyon ng kinetika ng kemikal bilang isang agham ay inilatag sa simula ng siglo ng mga gawa ng mga nagwagi ng Nobel na sina J. Van't Hoff (1901), S. Arrhenius (1903), W. Ostwald (1909), gayundin ni M Bodenstein. Ang iba't ibang aspeto ng teorya ng isang elementarya ay binuo ni G. Eyring, M. Polyani, V. G. Levich at R. R. Dogonadze, mga nanalo ng Nobel Prize na sina K. Fukui at R. Hoffman (1981), G. Taube (1983), R. Marcus (1992) at marami pang ibang mananaliksik. Ang teorya ng chain reactions ay nilikha ng mga gawa ni M. Bodenstein, J. Christiansen at Nobel laureates N.N.N.Hinshelwood at S.N.
Ang mga Nobel Prize ay iginawad sa mga pamamaraan at resulta ng pananaliksik sa mabilis na mga reaksyon sa elementarya (M. Eigen, J. Porter, R. Norrish, 1967), pati na rin ang pagbuo ng mga pamamaraan para sa pag-aaral ng dinamika ng mga elementarya na pagkilos ng mga reaksyon ng gas-phase ( D. Herschbach, Ya Li, J. Polyani, 1986).
Ang mga natitirang resulta ay nakuha sa larangan ng kinetics ng homogenous at heterogenous catalytic reactions. Pansinin na lang natin ang teorya
kinetics ng mga heterogenous na reaksyon sa hindi magkakatulad na mga ibabaw (M.I. Temkin at S.Z. Roginsky), ang teorya ng kinetics ng mga nakatigil na reaksyon ng Horiuchi-Temkin, pagtuklas ng catalysis ng oxidative transformations ng olefins sa pamamagitan ng palladium complexes (I.I. Moiseev, M.N. Vargaftik, Yargaftik, Ya. , Yu. Smidt, atbp.) at ang paglikha ni I.I Moiseev ng teorya ng mga prosesong ito batay sa mga detalyadong kinetic na pag-aaral (A.P. Karpinsky Prize, 1999).
Ang ikadalawampu siglo ay nakoronahan ng kahanga-hangang pagtuklas ng isang bagong larangan ng pisikal na kimika ng elementarya, na tinatawag na "femtochemistry," at ang 1999 Nobel Prize sa Chemistry sa American scientist, Egyptian A. Zewail "para sa kanyang pag-aaral ng mga estado ng paglipat gamit ang ang femtosecond (10–15 sec) na pamamaraan ng laser spectroscopy". Naabot na ang limitasyon para sa pagsukat ng mga rate ng mga reaksiyong kemikal. Naging posible na subaybayan ang mga prosesong nagaganap sa isang panginginig ng boses ng mga atom sa isang kemikal na bono - 10 - 100 fs. Ang estado ng paglipat ng isang bilang ng mga reaksyon ay naitala na may isang resolusyon na 0.1 A kasama ang coordinate ng reaksyon na may isang buong parang multo na larawan. Ang antas ng resolusyon ng mga katabing estado ng enerhiya na ~10–4 cm–1 ay nakamit.
Ang lahat ng mga resulta ng pag-aaral ng "nonequilibrium" kinetics ng mga reaksiyong kemikal sa microlevel ay napakahalaga para sa pagpapatunay ng mga pangunahing prinsipyo ng kinetics ng kemikal, ngunit sa ngayon ay hindi gaanong ginagamit para sa paglutas ng mga problema sa antas ng macro - pag-aaral ng mga mekanismo ng mga kumplikadong reaksyon sa mga gas, mga solusyon. at sa ibabaw ng isang solid sa ilalim ng mga kondisyon ng pamamahagi ng Maxwell-Boltzmann, i.e. .e. mga problema ng "equilibrium" kinetics ng mga reaksiyong kemikal. Kung ang problema sa pagpapaliwanag ng mga mekanismo at pagbuo ng mga kinetic na modelo ng mga kumplikadong reaksyon para sa "equilibrium" kinetics ng gas-phase radical chain reactions ay praktikal na nalutas (dahil sa posibilidad ng pagbuo ng maximum na mga mekanismo o mga network ng reaksyon na may kilalang rate constants ng elementary stages), pagkatapos ay para sa mga kumplikadong proseso ng multi-ruta sa mga solusyon at sa ibabaw ang solusyon ay ang gawaing ito ay nagsisimula pa lamang. Ito ay isang problema sa ika-21 siglo.
2 Kinetics ng homogenous na kemikal na reaksyon
Ang rate ng isang kemikal na reaksyon ay ang pagbabago sa bilang ng mga moles ng mga reactant bilang isang resulta ng pakikipag-ugnayan ng kemikal sa bawat yunit ng oras bawat dami ng yunit (para sa mga homogenous na reaksyon) o bawat yunit ng ibabaw (para sa mga heterogenous na proseso):
kung saan ang C ay konsentrasyon, mol/m3,
o
Ang isa sa mga pangunahing batas ng kemikal na kinetika, na tumutukoy sa dami ng mga pattern ng mga rate ng elementarya na reaksyon, ay ang batas ng mass action. .
Ayon sa kinetic law ng mass action, ang rate ng isang elementarya na reaksyon sa isang naibigay na temperatura ay proporsyonal sa produkto ng mga konsentrasyon ng mga tumutugon na sangkap sa isang kapangyarihan na nagpapahiwatig ng bilang ng mga particle na nakikipag-ugnayan (stoichiometric coefficients):
nasaan ang pre-exponential factor; E - activation energy, ;
T – temperatura, K; R - pare-pareho ng gas, .
Ang mga constant ng rate para sa mga reaksyon ng iba't ibang mga order ay may iba't ibang dimensyon. Ang rate na pare-pareho para sa unang-order (monomolecular) na mga reaksyon ay may sukat Sa
-1
, second order rate constant (bimolecular) – l/(mol*s).
Batay sa mga equation (4) at (5), maaari nating isulat ang:
- = (6a)
Iniuugnay ng mga kinetic equation ang rate ng isang reaksyon sa mga parameter kung saan ito nakasalalay. Ang pinakamahalaga sa mga parameter na ito ay konsentrasyon, temperatura, presyon, at aktibidad ng katalista.
Isaalang-alang ang isang homogenous na reaksyon,
Mayroong kaugnayan sa pagitan ng mga rate ng reaksyon para sa mga indibidwal na sangkap (ipahiwatig natin ang mga ito na W A, W B, W C, W D) at ang pangkalahatang rate ng reaksyon W
Upang mailapat ang batas ng aksyong masa sa isang kumplikadong reaksyong kemikal, kinakailangan na katawanin ito sa anyo ng mga elementarya na yugto at ilapat ang batas na ito sa bawat yugto nang hiwalay.
3 Mga halimbawa ng pagmomodelo ng kinetic equation ng homogenous na kemikal na reaksyon
Kaya, ang mga kinetic na modelo ng homogenous na kemikal na reaksyon ay kumakatawan sa mga sistema ng ordinaryong kaugalian na equation ng balanse ng materyal.Bilang resulta ng paglutas ng sistema ng mga differential equation, nakukuha namin ang mga dependency ng mga pagbabago sa mga konsentrasyon ng mga chemical reagents sa paglipas ng panahon.
- 4 Numerical na pamamaraan para sa paglutas ng kinetic equation
Ang pinakasimpleng numerical na paraan para sa paglutas ng mga ordinaryong differential equation ay ang Euler method. Ang pamamaraang ito ay batay sa pagtatantya ng derivative para sa maliliit na pagbabago sa argumento.
Ang pangunahing pormula ng pamamaraan ni Euler ay ang mga sumusunod
, (11)
saan sa i+1 – ang halaga ng gustong variable sa susunod na hakbang;
sa i – ang halaga ng nais na variable sa kasalukuyang hakbang;
f i – kanang bahagi ng differential equation;
h – hakbang ng pagsasama.
Halimbawa, ang rate ng isang kemikal na reaksyon ay inilalarawan ng equation
ang dami ay tinatawag na integration step. Ang paglutas ng equation (14), makuha natin ang pangkalahatang formula ng Euler
| , | (15) |
.
Ang pagkakaroon ng itakda ang mga paunang kondisyon: sa t=0, С=С 0, ang halaga ng integration step h, pati na rin ang mga parameter ng equation, gamit ang formula (15) maaari kang magsagawa ng sunud-sunod na pagkalkula at kumuha ng solusyon sa equation na ito (Figure 1).
Magbigay tayo ng isang halimbawa ng pagsasama ng unang hakbang ng sistema ng mga equation (13) gamit ang Euler method:
C A1 (t 1) = C A0 (t 0) +h· (-k·C A);
C B1 (t 1)= C B0 (t 0) +h· (k·C A);
Ang mga resulta ng unang hakbang ay nakasalalay sa paunang konsentrasyon ng mga reactant (C A0 at C B0) at ang laki ng hakbang h .
Sa pamamagitan ng pag-aayos ng mga cyclic na kalkulasyon ayon sa equation (15), nakukuha namin para sa kinetic model ang pagbabago sa mga konsentrasyon ng mga tumutugon na sangkap sa paglipas ng panahon.
Ang laki ng hakbang sa pagsasama ay pinili batay sa pagkamit ng pinakamababang oras ng pagkalkula at ang pinakamaliit na error sa pagkalkula.
Figure 1. Graphical na paglalarawan ng pamamaraan ni Euler
5 Pag-aaral ng kinetics ng homogenous na kemikal na reaksyon
Ang pag-aaral ng mga kinetic pattern ng isang kemikal na reaksyon gamit ang pamamaraan ng pagmomodelo ng matematika ay nagsasangkot ng pagtukoy ng mga pagbabago sa mga konsentrasyon ng mga tumutugon na sangkap sa paglipas ng panahon sa isang partikular na temperatura.
Hayaang maganap ang mga reaksiyong kemikal
k 1 k 2
A ® B +2C ® D.
Batay sa batas ng mass action, isinulat namin ang mga equation para sa mga rate ng mga reaksiyong kemikal at lumikha ng isang kinetic na modelo:
| ; ; ; ; , |
k i - rate constant ng i-th chemical reaction ng unang order, s -1; (para sa pangalawang-order na mga reaksyon ang dimensyon ng pare-pareho ; para sa mga third-order na reaksyon ang dimensyon ay pare-pareho). W i - rate ng i-th chemical reaction, mol/l? Sa; t - oras ng reaksyon, s.
Ang isang sistema ng first-order ordinary differential equation ay malulutas gamit ang numerical method ni Euler, na ang algorithm ay nakasulat ayon sa equation (15).
Ang isang flow diagram para sa pagkalkula ng mga kinetics ng isang homogenous na kemikal na reaksyon gamit ang Euler method ay ipinapakita sa Figure 2.
Ang mga resulta ng isang pag-aaral gamit ang isang modelo ng matematika ng impluwensya ng temperatura sa antas ng conversion ng paunang reagent at sa konsentrasyon ng mga sangkap ay ipinakita sa Mga Figure 3 at 4.
Ang mga resulta na nakuha ay nagpapahintulot sa amin na gumuhit ng isang konklusyon tungkol sa pinakamainam na oras para sa pagsasagawa ng proseso upang makuha ang target na produkto. Ginagawa rin ng modelo ng matematika na pag-aralan ang impluwensya ng komposisyon ng hilaw na materyal sa ani ng mga produkto ng reaksyon.
Dapat itong isaalang-alang na ang rate ng isang kemikal na reaksyon ay nakasalalay sa temperatura, samakatuwid, upang magamit ang isang kinetic na modelo upang pag-aralan ang proseso sa iba't ibang mga temperatura, ito ay kinakailangan upang ipakilala ang pag-asa ng rate constant ng isang kemikal na reaksyon sa temperatura ayon sa Arrhenius equation.
Figure 2. Block - diagram para sa pagkalkula ng kinetics ng isang homogenous na kemikal
reaksyon sa pamamagitan ng pamamaraan ni Euler
6 Mga uri ng mga modelo para sa matematikal na paglalarawan ng mga kumplikadong proseso
Mayroong tatlong uri ng mga modelo ng matematika (mga paglalarawang matematika) ng mga kumplikadong proseso. Ang mga stochastic na modelo ay gumagamit ng mga probabilistikong ideya tungkol sa mga proseso sa object ng pag-aaral. Ang mga function ng pamamahagi ng probabilidad ay kinakalkula para sa mga variable na parameter ng modelo (konsentrasyon, temperatura sa kaso ng mga proseso ng kemikal). Ang mga modelong ito ay bihirang ginagamit pa rin sa mga kemikal na kinetika, ngunit napatunayang kapaki-pakinabang ang mga ito para sa paglalarawan at pagmomodelo ng pag-uugali ng malalaking sistema (mga kemikal na kumplikado, mga kemikal na halaman). Ginagamit ang mga istatistikal na modelo upang ilarawan ang isang eksperimento sa isang gumaganang bagay sa pananaliksik. Ang ugnayan sa pagitan ng mga halaga ng mga variable na pumapasok at lumalabas sa system ay inilarawan nang hindi gumagamit ng pisikal at kemikal na impormasyon tungkol sa mga prosesong nagaganap sa bagay (modelo ng black box). Ang mga matematikal na paglalarawan ng pag-uugali ng system ay karaniwang mga equation sa anyo ng mga polynomial. Upang matiyak ang istatistikal na kalayaan ng mga parameter ng modelo, ginagamit ang pang-eksperimentong disenyo (halimbawa, mga orthogonal na eksperimentong disenyo). Ang mga deterministikong modelo ay batay sa mga batas ng pisikal at kemikal na mga proseso na may partikular na istraktura ng modelo. Ang mga modelong kinetiko na batay sa teorya ay tiyak na mga naturang modelo.
Sa pagmomodelo ng matematika ng proseso ng catalytic, mayroong isang tiyak na hierarchy ng mga modelo ng matematika. Ang mga modelo ng unang antas ay mga kinetic na modelo ng mga proseso sa butil ng solid catalyst o sa elementary volume ng liquid phase sa isang homogenous na reaksyon, hindi kumplikado ng mga proseso ng mass transfer, init at hydrodynamic na mga kadahilanan. Isinasaalang-alang ng mga pangalawang antas na modelo sa heterogenous catalysis ang mga proseso sa catalyst layer, at ang mga third-level na modelo sa homogenous at heterogenous catalysis ay mga modelo ng reactor sa kabuuan, kabilang ang lahat ng proseso ng paglipat at istraktura ng daloy. Ang ganitong mga modelo ay kinakailangan upang pag-aralan ang mga bagong reaksyon, upang ma-optimize ang mga proseso ng catalytic, upang makalkula ang mga pang-industriyang reactor (bilang mga bahagi ng isang modelo ng matematika ng isang reaktor), upang lumikha ng mga awtomatikong sistema ng kontrol sa proseso.
7 Tungkol sa konsepto ng "mekanismo ng reaksyon"
Kaya, ang batayan para sa pagbuo ng isang CM ay ang mekanismo ng proseso, i.e. isang hanay ng mga elementarya na yugto na humahantong sa pagbabagong-anyo ng mga paunang reagent sa mga produktong panghuling reaksyon, at para sa parehong reaksyon (catalytic o non-catalytic) mayroong isang tiyak na hanay ng mga mekanismo na tinutukoy ng kasalukuyang katawan ng kaalaman at mga paradigm na gumagana sa kimika .Halimbawa, para sa nucleophilic substitution reaction sa aromatic ring ng ArX (non-catalytic, catalyzed ng mga metal complex o sapilitan ng paglipat ng electron mula at papunta sa ArX), 8 mekanismo ang naitatag:
13 isang ruta at 80 dalawang-ruta na mekanismo para sa simpleng reaksyon ng ethylene hydrogenation sa mga metal catalyst ay iminungkahi. Sa madaling salita, para sa bawat sistema ng reaksyon (reagents, catalyst) mayroong isang tiyak na hanay ng mga elementarya na yugto - isang network ng reaksyon (maximum na mekanismo), ang mga indibidwal na bloke na kung saan ay ipinatupad depende sa likas na katangian ng katalista, mga kondisyon, mga substituent sa substrate, at ang antas ng oksihenasyon ng metal catalyst.
Sa pagtatapos ng siglo, nagkaroon ng pagkakaisa ng physicochemical at pormal na kinetic approach sa pag-aaral ng mga mekanismo. Ang isang pananaw ay nabuo sa mekanismo bilang ang pagkakaisa ng dalawang bahagi ng konseptong ito - ang topological (istruktura) at mga sangkap ng kemikal, at sa kanilang pagkakapantay-pantay - imposibleng malinaw na maitatag ang istraktura ng mekanismo (ang relasyon ng mga elementarya na yugto). sa batayan lamang ng isang pormal na kinetic na paglalarawan, ang tinatawag na "mechanism diagram" , at pagkatapos ay punan ito ng kemikal na nilalaman. Sa pangkalahatang kaso, imposibleng makuha mula sa kinetic na mga eksperimento ang impormasyong kinakailangan para sa tamang pagkakakilanlan ng diagram ng mekanismo nang hindi tinukoy ang mekanismong ito at nang hindi nagtatakda ng mga kaukulang problema para sa pormal na pamamaraan ng kinetic.
Ang lahat ng mga pangyayaring ito ay nangangailangan ng rebisyon ng tradisyonal na diskarte para sa pagbuo ng CM.
8 Mga alternatibong diskarte sa pagmomodelo ng CM
Kasama sa tradisyonal na pamamaraan para sa pagbuo ng CM ang mga sumusunod na hakbang:Ang pangunahing kawalan ng pamamaraang ito (diskarte) ay ang kakulangan ng mga algorithm para sa hindi malabo na pagsasagawa ng lahat ng mga yugto. Dahil ang isang eksperimento ay maaaring sapat na inilarawan ng isang malaking bilang ng mga mathematical na modelo (equation), ang mananaliksik ay dapat magkaroon ng ilang hypothesis tungkol sa disenyo ng mekanismo (tungkol sa istruktura ng mekanismo) o tungkol sa anyo ng mga iminungkahing equation. Sa kasong ito, ang pagpili ng mga posibleng hypotheses (kung minsan ay intuitive) ay nangyayari pagkatapos maisagawa ang eksperimento. Walang algorithm para sa paglipat mula sa isang mathematical na modelo patungo sa isang pisikal na modelo (lalo na para sa mga multi-ruta na reaksyon) (hakbang (b)). Ang paglipat sa mekanismo ng reaksyon (hakbang (c)) ay arbitrary din at hindi pormal. Sa lahat ng mga yugto ng diskarteng ito, mayroong likas na pagnanais na makakuha ng hindi bababa sa isang equation (at "diagram ng mekanismo") na hindi sumasalungat sa eksperimento, at, kadalasan, walang pag-uusap tungkol sa anumang diskriminasyon ng isang hanay ng mga hypotheses. Sa kabaligtaran, ang mga may-akda ng gayong pamamaraan ng mekanismo ay nagsimulang magsagawa ng mga eksperimento upang patunayan ang mekanismo na tila sa may-akda ang pinaka-makatwiran. Kasabay nito, matagal nang itinatag na imposibleng patunayan ang anumang hypothesis. Posibleng ipakita na itapon ang mga hindi gumaganang hypotheses at magpakita ng kasunduan sa eksperimento ng mga natitirang hypotheses - ang hanay ng mga working hypotheses. Ang pagiging posible ng paglalagay ng isang hanay ng mga hypotheses at pagkuha ng maraming gumaganang hypotheses ay kapani-paniwalang nabigyang-katwiran mahigit 100 taon na ang nakalilipas ng American geologist na si T. Chamberlain.
Kaya, ang isang makatwirang diskarte para sa pagbuo ng isang CM ay isang malinaw na pamamaraan na makatwiran sa hypothetico-deductive na lohikal na pamamaraan ng pananaliksik, na sinusuportahan ng mga kakayahan ng mga computer at epektibong software. Ang kakanyahan ng diskarte na ito ay makikita sa pagkakasunud-sunod ng mga yugto nito:
Maaaring kabilang sa diskriminasyon ng mga hypotheses ang diskriminasyon sa mga yugto, mga bloke ng mga yugto, mga indibidwal na mekanismo, at mga node ng interface sa mga reaksyong multi-ruta.
Ang uri ng CM (form ng mathematical na paglalarawan) ay nakasalalay sa mga katangian ng mekanismo (linear o nonlinear), ang mga kondisyon ng proseso (nakatigil, parang nakatigil, hindi nakatigil), ang uri ng reaktor (bukas, sarado) at isang bilang ng mga tinatanggap na pagpapalagay. Ang linear na mekanismo ay isang mekanismo na ang mga elementarya na yugto sa pasulong at pabalik na direksyon ay linear sa mga intermediate—isang intermediate lamang ang matatagpuan sa kaliwa (o kanan) ng arrow sa elementarya na yugto. Kung higit sa isang intermediate ang kasangkot sa isang yugto (kabilang ang 2 molekula ng isang intermediate), ang mga yugto ay nonlinear at ang mekanismo ay nonlinear.
Ang pinaka-pangkalahatang uri ng quantum mechanics ay mga sistema ng differential equation, algebraic-differential o algebraic equation
,
(16)
ang kanang bahagi ay palaging produkto ng matrix ng stoichiometric coefficients para sa mga yugto ng mekanismo (transposed) ng column vector ng mga bilis ng elementary stages (). Sa kaso ng mga linear na mekanismo para sa mga reaksyon sa ilalim ng hindi gumagalaw o quasi-stationary na mga kondisyon, ang kanang bahagi ng equation (1) ay binago sa fractional rational rate equation para sa mga reactant ( R i) o mga bilis ng ruta ( R p). Ang mga sistema ng algebraic equation para sa mga nonlinear na mekanismo sa pangkalahatang kaso ay hindi nalulutas, at ang mga equation tulad ng (16) ay hindi binabawasan sa isang mas simpleng fractional-rational form.
Sa kaso ng mga kinetics sa hindi magkakatulad na mga ibabaw sa ilalim ng nakatigil na mga kondisyon, ang rate ay maaari ding ilarawan ng isang power equation tulad ng (17) (M.I. Temkin's equation para sa ammonia synthesis):
(17)
Coefficient m= 0.5 sa kaso ng isang iron catalyst, k + /k – = K– pare-pareho ang balanse ng reaksyon
Ang direktang problema ng chemical kinetics ay nauunawaan bilang ang problema ng paghahanap ng mga konsentrasyon ng mga sangkap na nakikilahok sa reaksyon sa anumang oras, batay sa mga kilalang paunang konsentrasyon, ang scheme ng reaksyon at mga constant ng rate ng mga indibidwal na yugto. Ang kabaligtaran na problema ng kinetics ng kemikal ay ang pagpapanumbalik ng kilalang pag-asa ng konsentrasyon ng mga sangkap sa oras ng scheme ng reaksyon at mga constant ng rate.
9.1 Pag-uuri ng mga kabaligtaran na problema
Ang pormal na kinetics ng homogenous na kemikal na reaksyon ay batay sa dalawang pangunahing postulates. Ayon sa (kinetic) na batas ng mass action, ang bilis ng elementary stage ay proporsyonal sa konsentrasyon ng mga reactant na kasangkot dito.
Ang proportionality coefficient ay tinatawag na rate constant. Ayon sa prinsipyo ng independiyenteng paglitaw ng mga indibidwal na yugto, ang rate ng reaksyon ay hindi nakasalalay sa kasalukuyang paglitaw ng iba pang mga reaksiyong kemikal sa system. Kaya, alam ang scheme ng reaksyon, madaling magsulat ng isang sistema ng mga ordinaryong equation ng kaugalian na sumasalamin sa pagbabago sa konsentrasyon ng lahat ng mga sangkap na nakikilahok sa reaksyon sa paglipas ng panahon:
d c/ dt
= f(k, c) (18)
kung saan ang c ay ang vector ng mga konsentrasyon ng sangkap, ang k ay ang vector ng mga constant ng rate ng mga indibidwal na yugto, ang anyo ng function f tinutukoy ng scheme ng reaksyon.
Ang pagsasama ng sistemang ito sa analytical o numerical, makuha namin ang:
c = F(k, c 0 , t)
(19)
kung saan ang c 0 ay ang vector ng mga paunang konsentrasyon ng mga sangkap.
Gamit ang notasyong ipinakilala sa itaas, maaari nating makilala ang ilang mga hakbang sa paglutas ng kabaligtaran na problema.
Zero stage - suriin ang kasapatan. Sinasagot nito ang tanong kung ang naobserbahang eksperimental na c(t) na mga kurba ay tumutugma sa mga kinakalkula gamit ang kasalukuyang modelong f at mga constant k.
Ang unang yugto ay parametric identification. Sa puntong ito
isang set ng mga constant k ang natagpuan na pinakamahusay na naglalarawan sa mga eksperimentong kurba c(t) sa loob ng modelong ito f. Malinaw na ang isang matagumpay na solusyon sa problema ng unang yugto ay posible lamang sa pamamagitan ng pag-asa sa zero stage.
Ang ikalawang yugto ay pagkakakilanlan ng istruktura. Pagpili ng modelo f, naaayon sa aktwal na nagaganap na reaksyong kemikal, na ginagawa batay sa paglutas ng problema sa unang yugto na may paglahok ng iba pang impormasyon tungkol sa mekanismo ng reaksyong ito.
.
9.2 Pagsusuri ng kasapatan at pagkakakilanlan ng parametric
Sa kaso ng isang medyo simpleng scheme ng reaksyon, kapag posible na makuha ang function c(t) sa isang tahasang anyo, ang pagsuri sa kasapatan ay binabawasan sa pagkalkula ng mga teoretikal na halaga ng pag-andar sa iba't ibang mga halaga ng oras at paghahambing ng mga ito sa mga pang-eksperimentong. Sa kasamaang palad, kadalasan ang mga sistema ng mga differential equation na naglalarawan ng mga kumplikadong reaksyong kemikal ay hindi maaaring maisama nang analytical, at ang isa ay kailangang gumamit ng mga pamamaraan ng pagsasama ng numero.
atbp.................