Mga compound ng Chromium. Mga oxide, hydroxides. Chromates. Mga dichromat. Oxidative properties ng chromium (VI) compounds. Aralin ng isang elective course na "Chromium at ang mga compound nito" Ang pagiging likas
- Pagtatalaga - Cr (Chromium);
- Panahon - IV;
- Pangkat - 6 (VIb);
- Mass ng atom - 51.9961;
- Atomic number - 24;
- Atomic radius = 130 pm;
- Covalent radius = 118 pm;
- Distribusyon ng elektron - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 ;
- temperatura ng pagkatunaw = 1857°C;
- punto ng kumukulo = 2672°C;
- Electronegativity (ayon kay Pauling/ayon kina Alpred at Rochow) = 1.66/1.56;
- Katayuan ng oksihenasyon: +6, +3, +2, 0;
- Densidad (no.) = 7.19 g/cm3;
- Dami ng molar = 7.23 cm 3 /mol.
Ang Chromium (kulay, pintura) ay unang natagpuan sa Berezovsky na deposito ng ginto (Middle Urals), ang mga unang binanggit ay nagmula noong 1763 sa kanyang gawa na "The First Foundations of Metallurgy" M.V. Lomonosov.

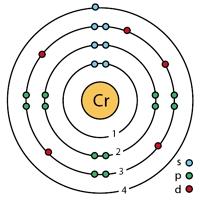
kanin. Istraktura ng chromium atom.
Ang electronic configuration ng chromium atom ay 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 (tingnan ang Electronic structure ng atoms). Ang pagbuo ng mga kemikal na bono sa iba pang mga elemento ay maaaring may kasamang 1 electron na matatagpuan sa panlabas na 4s level + 5 electron ng 3d sublevel (6 na electron sa kabuuan), samakatuwid, sa mga compound ang chromium ay maaaring tumagal ng mga estado ng oksihenasyon mula +6 hanggang +1 (ang pinaka karaniwan ay +6 , +3, +2). Ang Chromium ay isang kemikal na hindi aktibo na metal; ito ay tumutugon sa mga simpleng sangkap lamang sa mataas na temperatura.
Mga pisikal na katangian ng chromium:
- maasul na puting metal;
- napakatigas na metal (sa pagkakaroon ng mga impurities);
- marupok sa n. y.;
- plastik (sa dalisay nitong anyo).
Mga kemikal na katangian ng chromium
- sa t=300°C ay tumutugon sa oxygen:
4Cr + 3O 2 = 2Cr 2 O 3; - sa t>300°C ay tumutugon sa mga halogen, na bumubuo ng mga pinaghalong halides;
- sa t>400°C ay tumutugon sa sulfur upang bumuo ng mga sulfide:
Cr + S = CrS; - sa t=1000°C ang pinong giniling na chromium ay tumutugon sa nitrogen, na bumubuo ng chromium nitride (isang semiconductor na may mataas na katatagan ng kemikal):
2Cr + N 2 = 2CrN; - tumutugon sa dilute na hydrochloric at sulfuric acid upang maglabas ng hydrogen:
Cr + 2HCl = CrCl 2 + H 2;
Cr + H 2 SO 4 = CrSO 4 + H 2; - ang mainit na puro nitric at sulfuric acid ay natutunaw ang chromium.
May concentrated sulfuric at nitric acid sa no. hindi tumutugon ang chromium, at hindi rin natutunaw ang chromium sa aqua regia; Sa pangmatagalang pag-iimbak sa concentrated nitric acid, ang chromium ay natatakpan ng isang napakasiksik na oxide film (passivates) at humihinto sa pagtugon sa mga dilute acid.
Mga compound ng Chromium
Nasabi na sa itaas na ang "paboritong" oxidation states ng chromium ay +2 (CrO, Cr(OH) 2), +3 (Cr 2 O 3, Cr(OH) 3), +6 (CrO 3, H 2 CrO 4).
Ang Chrome ay chromophor, ibig sabihin, isang elementong nagbibigay kulay sa sangkap kung saan ito nakapaloob. Halimbawa, sa estado ng oksihenasyon +3, ang chromium ay nagbibigay ng isang lilang-pula o berdeng kulay (ruby, spinel, esmeralda, garnet); sa estado ng oksihenasyon +6 - kulay dilaw-kahel (crocoite).
Bilang karagdagan sa chromium, kasama rin sa chromophores ang iron, nickel, titanium, vanadium, manganese, cobalt, copper - lahat ng ito ay d-element.
Ang kulay ng mga karaniwang compound na kinabibilangan ng chromium:
- chromium sa estado ng oksihenasyon +2:
- chromium oxide CrO - pula;
- chromium fluoride CrF 2 - asul-berde;
- chromium chloride CrCl 2 - walang kulay;
- chromium bromide CrBr 2 - walang kulay;
- Chromium iodide CrI 2 - pula-kayumanggi.
- chromium sa estado ng oksihenasyon +3:
- Cr 2 O 3 - berde;
- CrF 3 - mapusyaw na berde;
- CrCl 3 - lila-pula;
- CrBr 3 - madilim na berde;
- CrI 3 - itim.
- chromium sa estado ng oksihenasyon +6:
- CrO 3 - pula;
- potassium chromate K 2 CrO 4 - dilaw na lemon;
- ammonium chromate (NH 4) 2 CrO 4 - gintong dilaw;
- calcium chromate CaCrO 4 - dilaw;
- Lead chromate PbCrO 4 - matingkad na kayumanggi-dilaw.
Mga Chromium oxide:
- Cr +2 O - pangunahing oksido;
- Cr 2 +3 O 3 - amphoteric oxide;
- Cr +6 O 3 - acidic oxide.
Chromium hydroxides:
- ".
Paglalapat ng chromium
- bilang isang alloying additive sa smelting ng heat-resistant at corrosion-resistant alloys;
- para sa chrome plating ng mga produktong metal upang mabigyan sila ng mataas na resistensya sa kaagnasan, paglaban sa abrasion at magandang hitsura;
- chromium-30 at chromium-90 alloys ay ginagamit sa plasma torch nozzles at sa aviation industry.
Tutor ng Chemistry
pagpapatuloy. Tingnan mo sa No. 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18/2008
ARALIN 25
Ika-10 grado(unang taon ng pag-aaral)
Chromium at mga compound nito
1. Posisyon sa talahanayan ng D.I Mendeleev, istraktura ng atom.
2. Pinagmulan ng pangalan.
3. Mga katangiang pisikal.
4. Mga katangian ng kemikal.
5. Ang pagiging likas.
6. Pangunahing paraan ng pagkuha.
7. Ang pinakamahalagang chromium compound:
a) chromium(II) oxide at hydroxide;
b) chromium(III) oxide at hydroxide, ang kanilang amphoteric properties;
c) chromium(VI) oxide, chromic at dichromic acid, chromates at dichromates.
9. Redox properties ng chromium compounds.
Ang Chromium ay matatagpuan sa pangalawang subgroup ng pangkat VI ng talahanayan ng D.I. Kapag kino-compile ang electronic formula ng chromium, kinakailangang tandaan na dahil sa higit na katatagan ng configuration 3 d 5, ang chromium atom ay may electron leak at ang electronic formula ay may anyo: 1 s 2 2s 2 p 6 3s 2 p 6 4s 1 3d 5 .
Sa mga compound, ang chromium ay maaaring magpakita ng oxidation states na +2, +3 at +6 (oxidation state +3 ang pinaka-stable): Nakuha ng Chrome ang pangalan nito mula sa salitang Griyego chroma
(kulay, pintura) dahil sa maliwanag na iba't ibang kulay ng mga compound nito.
Ang Chrome ay isang puting makintab na metal, napakatigas, malutong, at matigas ang ulo. Lumalaban sa kaagnasan. Kapag nalantad sa hangin, ito ay natatakpan ng isang oxide film, na nagiging sanhi ng ibabaw na maging matte.
Mga katangian ng kemikal
Sa normal na kondisyon, ang chromium ay isang hindi aktibong metal at tumutugon lamang sa fluorine. Ngunit kapag pinainit, ang chromium oxide film ay nawasak, at ang chromium ay tumutugon sa maraming simple at kumplikadong mga sangkap (katulad ng Al).
4Cr + 3O 2 2Cr 2 O 3 .
Mga Metal (–).
Mga hindi metal (+):
2Cr + 3Cl 2 2CrCl 3,
2Cr + 3F 2 = 2CrF 3,
2Cr + 3SCr 2 S 3,
H 2 O (+/–):*
2Cr + 3H 2 O (singaw)Cr 2 O 3 + 3H 2.
Mga pangunahing oksido (–).
Mga acidic oxide (–).
Mga Base (+/–):
2Cr + 6NaOH + 6H 2 O = 2Na 3 + 3H 2.
Non-oxidizing acids (+).
Cr + 2HCl = CrCl 2 + H 2.
Oxidizing acids (–). Kawalang-sigla.
Mga Asin (+/–):
2Cr + 3CuSO 4 = Cr 2 (SO 4) 3 + 3Cu,
Cr + CaCl 2 walang reaksyon.
Sa likas na katangian, ang elemento ng chromium ay kinakatawan ng apat na isotopes na may mass number na 50, 52, 53 at 54. Sa kalikasan, ang chromium ay matatagpuan lamang sa anyo ng mga compound, ang pinakamahalaga sa mga ito ay chromium iron ore, o chromite (FeOzhCr 2 O 3) at lead red ore (PbCrO 4).
Ang metallic chromium ay nakuha: 1) mula sa oxide nito gamit ang aluminothermy:
Cr 2 O 3 + 2Al 2Cr + Al 2 O 3,

2) electrolysis ng mga may tubig na solusyon o natutunaw ng mga asin nito:
Mula sa chromium iron ore, ang isang haluang metal ng bakal at kromo ay ginawa sa industriya - ferrochrome, na malawakang ginagamit sa metalurhiya:
FeO Cr 2 O 3 + 4CFe + 2Cr + 4CO.
MAHALAGANG COMPOUND NG CHROMA

Ang Chromium ay bumubuo ng tatlong oxides at ang kanilang mga katumbas na hydroxides, ang likas na katangian nito ay natural na nagbabago sa pagtaas ng estado ng oksihenasyon ng chromium: Ang (II) (CrO) ay isang solid, hindi matutunaw na substance sa tubig sa ilalim ng normal na mga kondisyon, maliwanag na pula o brownish-red ang kulay, isang tipikal na basic oxide. Ang Chromium(II) oxide ay madaling na-oxidize sa hangin kapag pinainit at nababawasan sa purong chromium.
CrO + 2HCl = CrCl 2 + H 2 O,
4CrO + O 2 2Сr 2 O 3,
CrO + H 2 Cr + H 2 O.
Ang Chromium(II) oxide ay nakukuha sa pamamagitan ng direktang oksihenasyon ng chromium:
2Cr + O 2 2СrO.
Chromium hydroxide(II) (Cr(OH) 2) – isang dilaw na sangkap na hindi matutunaw sa tubig, isang mahinang electrolyte, nagpapakita ng mga pangunahing katangian, at lubos na natutunaw sa mga puro acid; madaling oxidized sa pagkakaroon ng kahalumigmigan sa pamamagitan ng atmospheric oxygen; kapag pinainit sa hangin, nabubulok ito upang bumuo ng chromium(III) oxide:
Cr(OH) 2 + 2HCl = CrCl 2 + 2H 2 O,
4Cr(OH) 2 + O 2 2Сr 2 O 3 + 4H 2 O.
Ang Chromium(II) hydroxide ay nakukuha sa pamamagitan ng exchange reaction sa pagitan ng chromium(II) salt at alkali solution sa kawalan ng oxygen:
CrCl 2 + 2NaOH = Cr(OH) 2 + 2NaCl.
Ang Chromium ay bumubuo ng tatlong oxides at ang kanilang mga katumbas na hydroxides, ang likas na katangian nito ay natural na nagbabago sa pagtaas ng estado ng oksihenasyon ng chromium:(III) (Cr 2 O 3) ay nagpapakita ng amphoteric properties. Ito ay isang refractory (katigasan na maihahambing sa corundum) berdeng pulbos na hindi natutunaw sa tubig. Carcinogen!
Ito ay nakuha sa pamamagitan ng agnas ng ammonium dichromate, chromium(III) hydroxide, pagbabawas ng potassium dichromate o direktang oksihenasyon ng chromium:
(NH 4) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4H 2 O,
2Cr(OH) 3 Cr 2 O 3 + 3H 2 O,
Sa normal na kondisyon, ang chromium ay isang hindi aktibong metal at tumutugon lamang sa fluorine. Ngunit kapag pinainit, ang chromium oxide film ay nawasak, at ang chromium ay tumutugon sa maraming simple at kumplikadong mga sangkap (katulad ng Al).
2K 2 Cr 2 O 7 + 3C2Cr 2 O 3 + 2K 2 CO 3 + CO 2,
Sa ilalim ng normal na mga kondisyon, ang chromium(III) oxide ay hindi gaanong natutunaw sa mga acid at alkalis; ito ay nagpapakita ng amphoteric properties kapag pinagsama sa alkalis o sa alkali metal carbonates (na bumubuo ng chromites); Sa mataas na temperatura, ang chromium(III) oxide ay maaaring gawing purong metal:
Cr 2 O 3 + 2KOH 2KCrO 2 + H 2 O,
Cr 2 O 3 + Na 2 CO 3 2NaCrO 2 + CO 2,
Cr 2 O 3 + 6HCl = 2CrCl 3 + 3H 2 O,
Chromium hydroxide 2Cr 2 O 3 + 3C4Cr + 3CO 2.
(III) (Cr(OH) 3) ay idineposito sa pamamagitan ng pagkilos ng alkalis sa trivalent chromium salts (grey-green precipitate):
CrCl 3 + 3NaOH (kakulangan) = Cr(OH) 3 + 3NaCl.
Nagpapakita ito ng mga katangian ng amphoteric, natutunaw sa parehong mga acid at labis na alkalis; hindi matatag sa thermal:
Cr(OH) 3 + 3HCl = CrCl 3 + 3H 2 O,
Cr(OH) 3 + 3KOH = K 3,
Cr(OH) 3 + KOH KCrO 2 + 2H 2 O,
Ang Chromium ay bumubuo ng tatlong oxides at ang kanilang mga katumbas na hydroxides, ang likas na katangian nito ay natural na nagbabago sa pagtaas ng estado ng oksihenasyon ng chromium: 2Cr(OH) 3 Cr 2 O 3 + 3H 2 O.
(VI) (CrO 3) – isang mala-kristal na substansiya ng madilim na pulang kulay, nakakalason, nagpapakita ng mga katangiang acidic. Ito ay lubos na natutunaw sa tubig kapag ang oksido na ito ay natunaw sa tubig, ang mga chromic acid ay nabuo; kung paano nakikipag-ugnayan ang acidic oxide CrO 3 sa mga pangunahing oxide at alkalis; thermally hindi matatag; ay ang pinakamalakas na oxidizing agent:
CrO3 + H2O =
CrO 3 + K 2 OK 2 CrO 4,
CrO 3 + 2NaOH = Na 2 CrO 4 + H 2 O,
4CrO 3 2Cr 2 O 3 + 3O 2,

Ang oxide na ito ay nakukuha sa pamamagitan ng pagtugon sa mga tuyong chromate at dichromates na may puro sulfuric acid:
K 2 Cr 2 O 7 + H 2 SO 4 (conc.) 2CrO 3 + K 2 SO 4 + H 2 O,
K 2 CrO 4 + H 2 SO 4 (conc.) CrO 3 + K 2 SO 4 + H 2 O.
Chrome At dichromic acid umiiral lamang sa mga may tubig na solusyon, ngunit bumubuo ng mga matatag na asin - chromates At dichromates. Ang mga Chromate at ang kanilang mga solusyon ay dilaw sa kulay, habang ang dichromates ay orange. Ang mga chromate ions at dichromate ions ay madaling mag-transform sa isa't isa kapag nagbago ang kapaligiran ng solusyon. SA acidic na kapaligiran ang mga chromate ay nagiging dichromates, ang solusyon ay nakakakuha ng isang kulay kahel; sa isang alkalina na kapaligiran ang dichromates ay nagiging chromates, ang solusyon ay nagiging dilaw:
2K 2 CrO 4 + H 2 SO 4)K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O,
K 2 Cr 2 O 7 + 2KOH)2K 2 CrO 4 + H 2 O.
Ang ion ay matatag sa isang alkaline na kapaligiran, at sa isang acidic na kapaligiran.
Oxidative-pagbabawas ng mga katangian
C h r o m a n c o n d e n t s
Sa lahat ng chromium compound, ang pinaka-stable ay mga compound na may oxidation state ng chromium +3. Ang mga Chromium compound na may estado ng oksihenasyon na +2 ay malakas na mga ahente ng pagbabawas at madaling na-oxidize sa +3:
4Cr(OH) 2 + O 2 + 2H 2 O = 4Cr(OH) 3,
4CrCl 2 + 4HCl + O 2 = 4CrCl 3 + 2H 2 O.
Ang mga compound na naglalaman ng chromium sa +6 na estado ng oksihenasyon ay mga malakas na ahente ng pag-oxidizing ng chromium ay nababawasan mula +6 hanggang +3:
K 2 Cr 2 O 7 + 3H 2 S + 4H 2 SO 4 = 3S + Cr 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O.
Upang makita ang alkohol sa ibinubuga na hangin, ang isang reaksyon batay sa kakayahang mag-oxidize ng chromium(VI) oxide ay ginagamit:
4CrO 3 + 3C 2 H 5 OH 2Cr 2 O 3 + 3CH 3 COOH + 3H 2 O.
Ang isang solusyon ng potassium dichromate sa puro sulfuric acid ay tinatawag pinaghalong chrome at ginagamit sa paglilinis ng mga kemikal na babasagin.
Pagsubok sa paksang "Chromium at mga compound nito"
1. Ang ilang elemento ay bumubuo sa lahat ng tatlong uri ng mga oxide (basic, amphoteric at acidic). Ang estado ng oksihenasyon ng isang elemento sa isang amphoteric oxide ay magiging:
a) minimal;
b) pinakamataas;
c) intermediate sa pagitan ng minimum at maximum;
d) maaaring maging anuman.
2. Kapag ang bagong inihanda na precipitate ng chromium(III) hydroxide ay tumutugon sa labis na alkali solution, ang mga sumusunod ay nabuo:
a) katamtamang asin; b) pangunahing asin;
c) dobleng asin; d) kumplikadong asin.
3. Ang kabuuang bilang ng mga electron sa pre-external na antas ng chromium atom ay:
a) 12; b) 13; sa 1; d) 2.
4. Aling metal oxide ang acidic?
a) Copper(II) oxide; b) chromium(VI) oxide;
c) chromium(III) oxide; d) iron(III) oxide.
5. Anong masa ng potassium dichromate (sa g) ang kailangan upang ma-oxidize ang 11.2 g ng bakal sa isang sulfate solution?
a) 58.8; b) 14.7; c) 294; d) 29.4.
6. Anong masa ng tubig (sa g) ang dapat na sumingaw mula sa 150 g ng 10% na solusyon ng chromium(III) chloride upang makakuha ng 30% na solusyon ng asin na ito?
a) 100; b) 20; c) 50; d) 40.
7. Ang molar na konsentrasyon ng sulfuric acid sa solusyon ay 11.7 mol/L, at ang density ng solusyon ay 1.62 g/ml. Ang mass fraction ng sulfuric acid sa solusyon na ito ay katumbas (sa%):
a) 35.4; b) 98; c) 70.8; d) 11.7.
8. Ang bilang ng mga atomo ng oxygen sa 19.4 g ng potassium chromate ay:
a) 0.602 10 23; b) 2.408 10 23;
c) 2.78 10 23; d) 6.02 10 23 .
9. Ang Litmus ay magpapakita ng pulang kulay sa isang may tubig na solusyon (ilang mga tamang sagot ay posible):
a) chromium(III) chloride; b) chromium(II) chloride;
c) potasa klorido; d) hydrochloric acid.
10. Ang paglipat ng chromate sa dichromate ay nangyayari sa ... kapaligiran at sinamahan ng proseso:
a) acidic, proseso ng pagbabawas;
b) acidic, walang pagbabago sa mga estado ng oksihenasyon;
c) alkalina, proseso ng pagbabawas;
d) alkalina, walang pagbabago sa mga estado ng oksihenasyon.
Susi sa pagsubok
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| V | G | b | b | G | A | V | b | a, b, d | b |
Mga gawaing husay para sa pagtukoy ng mga sangkap 1. Ang isang may tubig na solusyon ng isang tiyak na asin ay nahahati sa dalawang bahagi. Ang isa sa kanila ay ginagamot ng labis na alkali at pinainit, binago ng inilabas na gas ang kulay ng pulang litmus sa asul. Ang iba pang bahagi ay ginamot ng hydrochloric acid; Anong asin ang sinuri? Suportahan ang iyong sagot gamit ang mga equation ng reaksyon.
Sagot. Ammonium carbonate.
2. Kapag ang ammonia, sodium sulfide at silver nitrate ay idinagdag (hiwalay) sa isang may tubig na solusyon ng sangkap A, ang mga puting precipitates ay nabuo, dalawa sa mga ito ay may parehong komposisyon. Ano ang substance A? Isulat ang mga equation ng reaksyon.
Solusyon
Substance A – AlCl 3 .
AlCl 3 + 3NH 4 OH = Al(OH) 3 + 3NH 4 Cl,
2AlCl 3 + 3Na 2 S + 6H 2 O 2Al(OH) 3 + 3H 2 S + 6NaCl,
AlCl 3 + 3AgNO 3 = 3AgCl + Al(NO 3) 3.
Sagot. Aluminyo klorido.
3. Kapag ang isang walang kulay na gas A na may isang malakas na katangian ng amoy ay sinunog sa presensya ng oxygen, isa pang gas B ay nabuo, walang kulay at walang amoy, na tumutugon sa temperatura ng silid na may lithium upang bumuo ng isang solidong sangkap C. Kilalanin ang mga sangkap, isulat ang mga equation ng reaksyon .
Solusyon
Substance A – NH 3,
sangkap B – N 2,
sangkap C – Li 3 N.
4NH 3 + 3O 2 2N 2 + 6H 2 O,
N 2 + 6Li = 2Li 3 N.
Sagot. NH 3, N 2, Li 3 N.
4. Ang walang kulay na gas A, na may katangian na masangsang na amoy, ay tumutugon sa isa pang walang kulay na gas, B, na may amoy ng bulok na mga itlog. Bilang resulta ng reaksyon, isang simpleng C at isang kumplikadong sangkap ay nabuo. Ang sangkap C ay tumutugon sa tanso upang bumuo ng isang itim na asin. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. SO 2, H 2 S, S.
5. Ang walang kulay na gas A na may matalas na katangian na amoy, mas magaan kaysa sa hangin, ay tumutugon sa malakas na acid B, na nagreresulta sa pagbuo ng asin C, isang may tubig na solusyon na hindi bumubuo ng pag-ulan na may alinman sa barium chloride o silver nitrate. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon (isa sa mga posibleng opsyon).
Sagot. NH 3, HNO 3, NH 4 NO 3.
6. Ang isang simpleng substansiya A, na nabuo ng mga atomo ng pangalawang pinakamaraming elemento sa crust ng lupa, ay tumutugon kapag pinainit ng iron(II) oxide, na nagreresulta sa pagbuo ng compound B, na hindi matutunaw sa may tubig na mga solusyon ng alkalis at acids (maliban sa hydrofluoric acid ). Ang sangkap B, kapag pinagsama sa quicklime, ay bumubuo ng hindi matutunaw na asin C. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon (isa sa mga posibleng opsyon).
Sagot. Si, SiO 2, CaSiO 3.
7. Ang kulay-kape na tambalang A, na hindi matutunaw sa tubig, ay nabubulok kapag pinainit upang bumuo ng dalawang oksido, ang isa ay tubig. Ang isa pang oxide, B, ay nababawasan ng karbon upang bumuo ng metal C, ang pangalawa sa pinakamaraming metal sa kalikasan. Kilalanin ang mga sangkap, isulat ang mga equation ng reaksyon.
Sagot. Fe(OH) 3, Fe 2 O 3, Fe.
8. Substance A, na bahagi ng isa sa mga pinaka-karaniwang mineral, kapag ginagamot sa hydrochloric acid ay bumubuo ng gas B. Kapag ang substance B ay tumutugon kapag pinainit ng isang simpleng substance C, isang compound lamang ang nabuo - isang nasusunog na gas na walang kulay at amoy. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. CaCO 3, CO 2, C.
9. Ang light metal A, na tumutugon sa dilute sulfuric acid, ngunit hindi tumutugon sa malamig na may concentrated sulfuric acid, ay tumutugon sa isang solusyon ng sodium hydroxide, sa gayon ay bumubuo ng gas at asin B. Kapag ang hydrochloric acid ay idinagdag sa sangkap B, ang asin C ay Nabuo ang mga sangkap, magbigay ng mga reaksyon ng equation.
Sagot. Al, NaAlO 2, NaCl.
10. Ang sangkap A ay isang malambot, pinutol ng kutsilyo, kulay-pilak na puting metal, mas magaan kaysa tubig. Kapag ang substance A ay tumutugon sa simpleng substance B, nabubuo ang compound C, na natutunaw sa tubig upang bumuo ng alkaline solution. Kapag ang isang sangkap ay ginagamot ng hydrochloric acid, ang isang gas na may hindi kanais-nais na amoy ay inilabas at isang asin ay nabuo, na nagiging kulay-ube ng apoy ng burner. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. K, S, K 2 S.
11. Ang walang kulay na gas A na may isang malakas na katangian ng amoy ay na-oxidized ng oxygen sa pagkakaroon ng isang katalista sa compound B, na isang pabagu-bago ng isip na likido. Ang sangkap B, na tumutugon sa quicklime, ay bumubuo ng asin C. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. SO 2, SO 3, CaSO 4.
12. Ang isang simpleng substansiya A, likido sa temperatura ng silid, ay tumutugon sa kulay-pilak-puting liwanag na metal B upang bumuo ng asin C, na, kapag ginagamot sa isang solusyon ng alkali, ay nagbibigay ng puting namuo na natutunaw sa labis na alkali. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. Br 2, Al, AlBr 3.
13. Ang isang dilaw na solidong simpleng substance A ay tumutugon sa isang kulay-pilak-puting light metal B, na nagreresulta sa pagbuo ng asin C, na ganap na nag-hydrolyze sa isang may tubig na solusyon upang bumuo ng isang puting namuo at isang nakakalason na gas na may hindi kanais-nais na amoy. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. S, Al, Al 2 S 3.
14. Ang isang simpleng hindi matatag na gas na sangkap A ay nagiging isa pang simpleng sangkap B, sa kapaligiran kung saan ang metal C ay nasusunog; ang produkto ng reaksyong ito ay isang oksido kung saan ang metal ay nasa dalawang estado ng oksihenasyon. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. O 3, O 2, Fe.
15. Ang isang madilim na lilang mala-kristal na substansiya A, kapag pinainit, ay nabubulok upang bumuo ng isang simpleng gas na sangkap B, sa kapaligiran kung saan ang isang simpleng sangkap na C ay nasusunog, na bumubuo ng isang walang kulay, walang amoy na gas, na kasama sa maliit na dami sa hangin. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. KMnO 4, O 2, C.
16. Ang isang simpleng substance A, na isang semiconductor, ay tumutugon sa isang simpleng gas na substance B upang bumuo ng compound C, na hindi matutunaw sa tubig. Kapag pinagsama sa alkalis, ang substance C ay bumubuo ng mga compound na tinatawag na soluble glasses. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon (isa sa mga posibleng opsyon).
Sagot. Si, O 2, SiO 2.
17. Ang isang lason na walang kulay na gas na may hindi kanais-nais na amoy ay nabubulok kapag pinainit sa mga simpleng sangkap, kung saan ang B ay isang dilaw na solid. Kapag nasusunog ang substance B, nabubuo ang walang kulay na gas C na may hindi kanais-nais na amoy, na nakakapagpawala ng kulay ng maraming organikong pintura. Kilalanin ang mga sangkap, magbigay ng mga equation ng reaksyon.
Sagot. H 2 S, S, SO 2.
18. Ang volatile hydrogen compound A ay nasusunog sa hangin upang bumuo ng substance B, na natutunaw sa hydrofluoric acid. Kapag pinagsama ang substance B sa sodium oxide, nabubuo ang nalulusaw sa tubig na asin C Kilalanin ang mga sangkap at magbigay ng mga equation ng reaksyon.
Sagot. SiH 4, SiO 2, Na 2 SiO 3.
19. Ang Compound A, na puti at bahagyang natutunaw sa tubig, bilang isang resulta ng calcination sa mataas na temperatura na may karbon at buhangin sa kawalan ng oxygen, ay bumubuo ng isang simpleng sangkap B, na umiiral sa ilang mga allotropic na pagbabago. Kapag ang sangkap na ito ay nasusunog sa hangin, ang tambalang C ay nabuo, na natutunaw sa tubig upang bumuo ng isang acid na may kakayahang bumuo ng tatlong serye ng mga asin. Kilalanin ang mga sangkap, isulat ang mga equation ng reaksyon.
Sagot. Ca 3 (PO 4) 2, P, P 2 O 5.
* Ang +/– sign ay nangangahulugan na ang reaksyong ito ay hindi nangyayari sa lahat ng reagents o sa ilalim ng mga partikular na kondisyon.
Itutuloy
DEPINISYON
Chromium- ang ikadalawampu't apat na elemento ng Periodic Table. Pagtatalaga - Cr mula sa Latin na "chromium". Matatagpuan sa ikaapat na yugto, VIB group. Tumutukoy sa mga metal. Ang nuclear charge ay 24.
Ang Chromium ay nakapaloob sa crust ng lupa sa halagang 0.02% (mass.). Sa kalikasan, ito ay matatagpuan pangunahin sa anyo ng chromium iron ore FeO×Cr 2 O 3.
Ang Chromium ay isang matigas, makintab na metal (Larawan 1), na natutunaw sa 1890 o C; ang density nito ay 7.19 g/cm 3 . Sa temperatura ng silid, ang chromium ay lumalaban sa tubig at hangin. Ang dilute sulfuric at hydrochloric acid ay natutunaw ang chromium, naglalabas ng hydrogen. Ang Chromium ay hindi matutunaw sa malamig na concentrated nitric acid at pagkatapos ng paggamot dito ay nagiging passive.
kanin. 1. Chrome. Hitsura.
Atomic at molecular mass ng chromium
DEPINISYON
Kamag-anak na molekular na timbang ng sangkap(M r) ay isang numero na nagpapakita kung gaano karaming beses ang mass ng isang partikular na molekula ay mas malaki kaysa sa 1/12 ng mass ng isang carbon atom, at relatibong atomic mass ng isang elemento(A r) - kung gaano karaming beses ang average na masa ng mga atom ng isang elemento ng kemikal ay mas malaki kaysa sa 1/12 ng masa ng isang carbon atom.
Dahil sa libreng estado, ang chromium ay umiiral sa anyo ng mga molekula ng monatomic Cr, ang mga halaga ng mga atomic at molekular na masa nito ay nag-tutugma. Ang mga ito ay katumbas ng 51.9962.
Isotopes ng chromium
Ito ay kilala na sa likas na chromium ay matatagpuan sa anyo ng apat na matatag na isotopes 50 Cr, 52 Cr, 53 Cr at 54 Cr. Ang kanilang mga mass number ay 50, 52, 53 at 54, ayon sa pagkakabanggit. Ang nucleus ng isang atom ng chromium isotope 50 Cr ay naglalaman ng dalawampu't apat na proton at dalawampu't anim na neutron, at ang natitirang isotopes ay naiiba lamang dito sa bilang ng mga neutron.
Mayroong mga artipisyal na isotopes ng chromium na may mga numero ng masa mula 42 hanggang 67, kung saan ang pinaka-matatag ay 59 Cr na may kalahating buhay na 42.3 minuto, pati na rin ang isang nuclear isotope.
Chromium ions
Sa panlabas na antas ng enerhiya ng chromium atom mayroong anim na electron, na kung saan ay valence:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 .
Bilang resulta ng pakikipag-ugnayan ng kemikal, ibinibigay ng chromium ang mga valence electron nito, i.e. ang kanilang donor, at nagiging isang positibong sisingilin na ion:
Cr 0 -2e → Cr 2+ ;
Cr 0 -3e → Cr 3+ ;
Cr 0 -6e → Cr 6+ .
Molekyul at atom ng Chromium
Sa malayang estado, ang chromium ay umiiral sa anyo ng mga molekulang monoatomic Cr. Narito ang ilang mga katangian na nagpapakilala sa chromium atom at molekula:
Mga haluang metal ng Chromium
Ang Chromium metal ay ginagamit para sa chrome plating at bilang isa sa pinakamahalagang bahagi ng alloy steels. Ang pagpapakilala ng chromium sa bakal ay nagpapataas ng paglaban nito sa kaagnasan kapwa sa may tubig na mga kapaligiran sa normal na temperatura at sa mga gas sa mataas na temperatura. Bilang karagdagan, ang mga chromium steel ay nadagdagan ang katigasan. Ang Chromium ay bahagi ng stainless acid-resistant at heat-resistant steels.
Mga halimbawa ng paglutas ng problema
HALIMBAWA 1
HALIMBAWA 2
| Mag-ehersisyo | Ang Chromium (VI) oxide na tumitimbang ng 2 g ay natunaw sa tubig na tumitimbang ng 500 g Kalkulahin ang mass fraction ng chromic acid H 2 CrO 4 sa resultang solusyon. |
| Solusyon | Isulat natin ang equation ng reaksyon para sa paggawa ng chromic acid mula sa chromium (VI) oxide: CrO 3 + H 2 O = H 2 CrO 4. Hanapin natin ang masa ng solusyon: m solusyon = m(CrO 3) + m (H 2 O) = 2 + 500 = 502 g. n (CrO 3) = m (CrO 3) / M (CrO 3); n (CrO 3) = 2 / 100 = 0.02 mol. Ayon sa equation ng reaksyon n(CrO 3) : n(H 2 CrO 4) = 1:1, na nangangahulugang n(CrO 3) = n(H 2 CrO 4) = 0.02 mol. Kung gayon ang masa ng chromic acid ay magiging pantay (molar mass - 118 g/mol): m (H 2 CrO 4) = n (H 2 CrO 4) × M (H 2 CrO 4); m (H 2 CrO 4) = 0.02 × 118 = 2.36 g. Ang mass fraction ng chromic acid sa solusyon ay: ω = m solute / m solusyon × 100%; ω (H 2 CrO 4)=m solute (H 2 CrO 4)/ m solusyon × 100%; ω (H 2 CrO 4) = 2.36 / 502 × 100% = 0.47%. |
| Sagot | Ang mass fraction ng chromic acid ay 0.47%. |
Chromium hydride
CrH(g). Ang mga thermodynamic na katangian ng gaseous chromium hydride sa karaniwang estado sa mga temperatura na 100 - 6000 K ay ibinibigay sa talahanayan. CrH.
Bilang karagdagan sa banda 3600 - 3700 Å, isa pang mas mahinang banda ng CrH ang nakita sa ultraviolet na rehiyon ng spectrum [55KLE/LIL, 73SMI]. Ang banda ay namamalagi sa rehiyon ng 3290 Å at may mga gilid ng isang kumplikadong istraktura. Hindi pa nasusuri ang banda.
Ang pinaka-pinag-aralan ay ang infrared system ng CrH bands. Ang sistema ay tumutugma sa paglipat A 6 Σ + - X 6 Σ + , ang gilid ng 0-0 na banda ay matatagpuan sa 8611 Å. Ang sistemang ito ay pinag-aralan sa [55KLE/LIL, 59KLE/UHL, 67O’C, 93RAM/JAR2, 95RAM/BER2, 2001BAU/RAM, 2005SHI/BRU, 2006CHO/MER, 2007CHE/STE, 2007CHE/BAK]. Sa gawaing [55KLE/LIL], isinagawa ang pagsusuri ng oscillatory structure sa mga gilid. Sa [59KLE/UHL], nasuri ang rotational structure ng 0-0 at 0-1 bands at naitatag ang uri ng transition 6 Σ - 6 Σ. Sa [67O'C], isinagawa ang rotational analysis ng 1-0 at 1-1 bands, pati na rin ang rotational analysis ng 0-0 band ng CrD. Sa [93RAM/JAR2], sa mas mataas na resolution na spectra na nakuha gamit ang Fourier spectrometer, ang mga posisyon ng mga linya ng 0-0 band ay pino, at mas tumpak na mga halaga ng mga rotational constant at fine structure constants ng upper at lower. mga estado ay nakuha. Ang pagsusuri ng mga perturbations sa A 6 Σ + state ay nagpakita na ang perturbing state ay isang 4 Σ + na may enerhiya T 00 = 11186 cm -1 at rotational constant B 0 = 6.10 cm -1 . Sa [95RAM/BER2] at [2001BAU/RAM], ang rotational structure ng mga banda 0-1, 0-0, 1-0 at 1-2 ng CrD molecule [95RAM/BER2] at 1-0 at 1 ay nakuha at sinuri gamit ang Fourier spectrometer -1 molecule CrH [2001BAU/RAM]. Noong [2005SHI/BRU], ang mga tagal ng v = 0 at 1 na antas ng A 6 Σ + na estado ay natukoy sa pamamagitan ng paraan ng resonant two-photon ionization, at ang mga wave number ng mga linya ng 0-0 band ng ang 50 CrH isotopomer ay sinukat. Noong [2006CHO/MER], ang mga wave number ng mga unang linya (N ≤ 7) ng 1-0 CrH band ay sinusukat sa laser excitation spectrum. Ang mga naobserbahang perturbation ng mga antas ng pag-ikot ng estado A 6 Σ + (v=1) ay iniuugnay sa mga estadong a 4 Σ + (v=1) at B 6 Π(v=0). Noong [2007CHE/STE], ang mga shift at split sa isang pare-parehong electric field ng unang ilang linya ng 0-0 CrD band ay sinusukat sa laser excitation spectra, at ang dipole moment sa mga estadong X 6 Σ + (v=0). ) at A 6 Σ + (v=0) ay natukoy ). Noong [2007CHE/BAK], pinag-aralan ang Zeeman splitting ng unang rotational lines ng 0-0 at 1-0 CrH bands sa laser excitation spectra. Ang infrared CrH system ay natukoy sa spectra ng araw [80ENG/WOH], S-type na mga bituin [80LIN/OLO] at brown dwarf [99KIR/ALL].
Ang mga vibrational transition sa ground electronic state ng CrH at CrD ay naobserbahan sa [79VAN/DEV, 91LIP/BAC, 2003WAN/AND2]. Sa [79VAN/DEV], ang mga frequency ng pagsipsip na 1548 at 1112 cm -1 sa Ar matrix sa 4 K ay itinalaga sa mga molekula ng CrH at CrD. Sa [91LIP/BAC], ang mga rotational lines ng vibrational transition 1-0 at 2-1 ng CrH molecule ay sinusukat gamit ang laser magnetic resonance, at nakuha ang vibrational constants ng ground state. Sa [2003WAN/AND2], ang mga molekula ng CrH at CrD, na isinasaalang-alang ang data mula sa [91LIP/BAC], ay itinalaga ang mga frequency ng pagsipsip sa Ar matrix na 1603.3 at 1158.7 cm‑1.
Ang mga rotational transition sa ground state ng CrH at CrD ay naobserbahan sa [91COR/BRO, 93BRO/BEA, 2004HAL/ZIU, 2006HAR/BRO]. Sa [91COR/BRO], humigit-kumulang 500 laser magnetic resonances na nauugnay sa 5 mas mababang rotational transition ang sinukat, at isang set ng mga parameter ang nakuha na naglalarawan sa rotational energy, fine at hyperfine splitting ng rotational level sa vibrational level v=0 ng estado ng lupa. Ang gawain [93BRO/BEA] ay nagpapakita ng mga pinong frequency ng 6 na bahagi ng rotational transition N = 1←0. Sa [2004HAL/ZIU], ang mga bahagi ng N = 1←0 CrH transition at ang mga bahagi ng N = 2←1 CrD transition ay direktang sinusukat sa submillimeter absorption spectrum. Ang mga bahagi ng N = 1←0 CrH transition ay muling sinukat (na may mas mahusay na signal-to-noise ratio) noong [2006HAR/BRO]. Ang data mula sa mga sukat na ito ay naproseso noong [2006HAR/BRO] kasama ang data ng pagsukat mula sa [91COR/BRO] at [91LIP/BAC], at ang kasalukuyang pinakamahusay na hanay ng mga constant, kabilang ang mga equilibrium, para sa ground state ng CrH ay nakuha.
Ang EPR spectrum ng isang CrH molecule sa isang Ar matrix ay pinag-aralan sa [79VAN/DEV, 85VAN/BAU]. Ito ay itinatag na ang molekula ay may ground state na 6 Σ.
Ang photoelectron spectrum ng CrH - at CrD - anion ay nakuha sa [87MIL/FEI]. Ayon sa interpretasyon ng mga may-akda, ang spectrum ay nagpapakita ng mga transisyon mula sa lupa at nasasabik na estado ng anion patungo sa lupa at A 6 Σ + na estado ng neutral na molekula. Ang ilang mga taluktok sa spectrum ay hindi itinalaga. Ang dalas ng vibrational sa ground state ng CrD ay natukoy na ~ 1240 cm -1.
Ang mga quantum-mechanical na kalkulasyon ng CRH ay ginawa sa trabaho [81Das, 82Gro/Wah, 83wal/Bau, 86cho/Lan, 93DAI/BAL, 96FUJ/IWA, 97BAR/ADA, 2001BAU/RAM, 2003ROO, 0/6O04 PER, 2006KOSOS /MAT, 2007JEN/ROO, 2008GOE/MAS ]. Ang mga enerhiya ng nasasabik na mga elektronikong estado ay kinakalkula sa [93DAI/BAL, 2001BAU/RAM, 2003ROO, 2004GHI/ROO, 2006KOS/MAT, 2008GOE/MAS].
Ang mga enerhiya ng mga nasasabik na estado ay ibinibigay ayon sa pang-eksperimentong data [93RAM/JAR2] ( a 4 Σ +), [ 2001BAU/RAM ] ( A 6 Σ +), [ 2006CHO/MER ] ( B 6 Π), [ 84HUGH/GER ] ( D(6 Π)) at tinantiya mula sa mga resulta ng pagkalkula [93DAI/BAL, 2006KOS/MAT] ( b 4 Π, c 4 Δ), [ 93DAI/BAL, 2003ROO, 2004GHI/ROO, 2006KOS/MAT ] ( C 6 Δ).
Ang vibrational at rotational constants ng excited states ng CrH ay hindi ginamit sa mga kalkulasyon ng thermodynamic function at ibinibigay sa Table Cr.D1 para sanggunian. Para sa estado A 6 Σ + experimental constants ay ibinibigay [2001BAU/RAM], rotational constant a Ang 4 Σ + ay ibinibigay ayon sa [93RAM/JAR2]. Para sa ibang mga estado ang mga halaga ng w e at r e na-average ayon sa mga resulta ng pagkalkula [93DAI/BAL] ( B 6 Π, C 6Δ, b 4 Π, c 4 Δ), [2003ROO] ( C 6 Δ), [ 2004GHI/ROO ] ( B 6 Π, C 6Δ, D(6 Π)), [ 2006KOS/MAT ] ( B 6 Π, C 6 Δ).
Ang mga istatistikal na timbang ng mga sintetikong estado ay tinatantya gamit ang modelong Cr + H - ion. Pinagsasama nila ang mga istatistikal na term na timbang ng Cr + ion na may tinantyang enerhiya sa larangan ng ligand sa ibaba 40,000 cm -1. Ang mga enerhiya ng mga termino sa larangan ng ligand ay tinatantya batay sa pag-aakalang ang mga kamag-anak na posisyon ng mga termino ng isang pagsasaayos ay pareho sa larangan ng ligand at sa libreng ion. Ang paglilipat ng mga pagsasaayos ng isang libreng ion sa larangan ng ligand ay tinutukoy batay sa interpretasyon (sa loob ng balangkas ng ionic na modelo) ng eksperimento na sinusunod at kinakalkula na mga elektronikong estado ng molekula. Kaya, ang ground state X 6 Σ + ay inilalagay sa pagsusulatan sa terminong 6 S ng configuration 3d 5, at ang mga estado A 6 Σ +, B 6 Π, C 6 Δ at 4 Σ +, 4 Π, 4 Δ - sa mga bahagi ng paghahati ng mga termino 6 D at 4 D configuration 4s 1 3d 4. Ang D(6 Π) na estado ay itinalaga sa 4p 1 3d 4 na configuration. Ang mga enerhiya ng mga termino sa isang libreng ion ay ibinibigay sa [71MOO]. Ang paghahati ng mga termino sa larangan ng ligand ay hindi isinasaalang-alang.
Ang mga thermodynamic function na CrH(g) ay kinakalkula gamit ang mga equation (1.3) - (1.6), (1.9), (1.10), (1.93) - (1.95). Mga halaga Q int at ang mga derivatives nito ay kinakalkula gamit ang mga equation (1.90) - (1.92) na isinasaalang-alang ang labing isang excited na estado sa ilalim ng pagpapalagay na Q kol.vr ( i) = (p i /p X)Q kol.vr ( X). Ang vibrational-rotational partition function ng X 6 Σ + state at ang mga derivatives nito ay kinakalkula gamit ang mga equation na K ‑1 × mol ‑1
H o (298.15 K)- H o (0) = 8.670 ± 0.021 kJ× mol ‑1
Ang mga pangunahing error sa kinakalkula na thermodynamic function ng CrH(g) ay dahil sa paraan ng pagkalkula. Ang mga error sa mga halaga ng Φº(T) sa T = 298.15, 1000, 3000 at 6000 K ay tinatantya sa 0.07, 0.2, 0.7 at 1.7 J × K ‑1 × mol ‑1, ayon sa pagkakabanggit.
Ang mga thermodynamic na function ng CrH(g) ay hindi pa nai-publish dati.
Thermochemical values para sa CrH(g).
Ang equilibrium constant ng reaksyon CrH(g)=Cr(g)+H(g) ay kinakalkula mula sa tinatanggap na halaga ng dissociation energy
D° 0 (CrH) = 184 ± 10 kJ× mol ‑1 = 15380 ± 840 cm -1.
Ang tinatanggap na halaga ay batay sa mga resulta ng mga pagsukat ng mga energies ng dalawang gas heterolytic reactions, katulad: CrH = Cr - + H + (1), ΔE(1) = 1420 ± 13 kJ × mol -1, ion cyclotron resonance method [85SAL/LAN] at CrH = Cr + + H - (2), ΔE(2) = 767.1 ± 6.8 kJ× mol -1, pagtukoy ng threshold energies para sa mga reaksyon ng pakikipag-ugnayan ng Cr + sa isang bilang ng mga amin [93CHE/ CLE]. Ang kumbinasyon ng mga halagang ito sa mga halagang tinatanggap sa publikasyong ito EA(H) = -72.770 ± 0.002 kJ× mol -1, IP(H) = 1312.049 ± 0.001 kJ× mol -1, IP(Cr ) = 652.869 ± 0.004 kJ× mol - 1, gayundin sa halagang EA(Cr) = -64.3 ± 1.2 kJ× mol -1 na ibinigay sa [85HOT/LIN] ay humahantong sa mga halaga D° 0 (CrН) = 172.3 ± 13 at D° 0 (CrH) = 187.0 ± 7 kJ× mol -1 para sa mga gawa [85SAL/LAN, 93CHE/CLE], ayon sa pagkakabanggit. Ang mga nakuhang halaga ay nasa makatwirang kasunduan; ang weighted average ay 184 ± 6 kJ× mol‑1. Ang kahulugan na ito ay pinagtibay sa publikasyong ito. Bahagyang nadagdagan ang error dahil sa mga kahirapan sa mapagkakatiwalaang pag-uugnay ng mga resulta ng mga nabanggit na gawa sa isang partikular na temperatura. Ang isang pagtatangkang tuklasin ang molekula ng CrH sa ilalim ng mga kondisyon ng ekwilibriyo (Knudsen mass spectrometry, [81KAN/MOO]) ay hindi nagtagumpay; ratio na ibinigay sa [81KAN/MOO] D Hindi sumasalungat sa rekomendasyon ang ° 0 (CrН) ≤ 188 kJ× mol‑1.
Ang tinatanggap na halaga ay tumutugma sa mga sumusunod na halaga:
Δ f Hº(CrH, g, 0 K) = 426.388 ± 10.2 kJ mol -1 at
Δ f Hº(CrH, g, 298.15 K) = 426.774 ± 10.2 kJ mol -1 .
17.doc
Chromium. Chromium (II), (III) at (VI) oxides. Hydroxides at salts ng chromium (II) at (III). Chromates at dichromates. Mga kumplikadong compound ng Chromium(III).
17.1. Maikling katangian ng mga elemento ng chromium subgroup

Ang chromium subgroup ay isang side subgroup ng pangkat VI ng periodic table ng mga elemento D.I. Mendeleev. Kasama sa subgroup ang chromium Cr, molybdenum Mo, tungsten W.
Ang mga elementong ito ay mga transition metal din, dahil binubuo nila ang d-sublevel ng pre-external na layer. Sa panlabas na layer ng mga atomo ng mga elementong ito mayroong isa (para sa chromium at molibdenum) o dalawa (para sa tungsten) na mga electron. Kaya, ang mga atomo ng mga elemento ng chromium subgroup ay may anim na valence electron na maaaring lumahok sa pagbuo ng isang kemikal na bono (tingnan ang Talahanayan 30).
Ang Chromium, molibdenum, at tungsten ay magkapareho sa maraming pisikal at kemikal na mga katangian: sa gayon, sa anyo ng mga simpleng sangkap, lahat sila ay matigas ang ulo pilak-puting mga metal na may malaking katigasan at isang bilang ng mga mahalagang mekanikal na katangian - ang kakayahang gumulong, gumuhit , at povke.
Mula sa chemical point of view, lahat ng metal ng chromium subgroup ay lumalaban sa hangin at tubig (sa ilalim ng normal na kondisyon, lahat sila ay nakikipag-ugnayan sa oxygen, halogens, phosphorus, at carbon);
Sa ilalim ng impluwensya ng puro acids (HNO 3, H 2 SO 4) sa mga ordinaryong temperatura, ang mga metal ng chromium subgroup ay passivated.

Para sa lahat ng elemento ng chromium subgroup, ang pinakakaraniwang mga compound ay kung nasaan ang kanilang mga estado ng oksihenasyon +2, +3, +6 (bagaman may mga compound kung saan ang kanilang mga degree ay maaari ding maging +4 at +5, at para sa chromium +1). Ang mga elemento ng chromium subgroup ay walang negatibong oxidation state, at hindi sila bumubuo ng volatile hydrogen compounds. Ang mga solid hydride tulad ng CrH 3 ay kilala lamang para sa chromium. Ang mga compound ng divalent na elemento ay hindi matatag at madaling na-oxidize sa mas mataas na estado ng oksihenasyon.
Sa isang pagtaas sa antas ng oksihenasyon, ang acidic na likas na katangian ng mga oxide ay tumataas na may pinakamataas na estado ng oksihenasyon na +6, ang mga oxide ng uri ng RO 3 ay nabuo, na tumutugma sa mga acid H 2 RO 4. Ang lakas ng mga acid ay natural na bumababa mula sa chromium hanggang sa tungsten. Karamihan sa mga asin ng mga acid na ito ay bahagyang natutunaw sa tubig;
Tulad ng sa ibang mga kaso, ang mga metal na katangian ng mga elemento ng chromium subgroup ay tumataas sa pagtaas ng atomic number.
Stva. Ang aktibidad ng kemikal ng mga metal sa chromium - molybdenum - tungsten series ay kapansin-pansing bumababa.
Ang lahat ng mga metal ng chromium subgroup ay malawakang ginagamit sa modernong teknolohiya, lalo na sa industriya ng metalurhiko para sa paggawa ng mga espesyal na bakal.
17.2. Chromium
Ang pagiging nasa kalikasan
Ang Chromium ay isang medyo karaniwang elemento; Ang Chromium ay eksklusibong matatagpuan sa mga compound; ang mga pangunahing mineral ay chromite FeCr 2 O 4 (o FeO Cr 2 O 3), o chromium iron ore, at crocoite PbCtO 4 (o PbO CrO 3). Ang kulay ng maraming elemento ay dahil sa pagkakaroon ng chromium sa kanila. Halimbawa, ang ginintuang-berdeng tono ng isang esmeralda o ang pulang tono ng isang ruby ay ibinibigay ng isang admixture ng chromium oxide Cr 2 O 3.
Resibo
Ang hilaw na materyal para sa pang-industriyang produksyon ng chromium ay chromium iron ore. Ang pagpoproseso ng kemikal nito ay humahantong sa Cr 2 O 3. Ang pagbabawas ng Cr 2 O 3 na may aluminyo o silikon ay gumagawa ng metal na kromo na may mababang kadalisayan:
Cr 2 O 3 +Al=Al 2 O 3 +2Cr
2Cr 2 O 3 +3Si=3SiO 2 +4Cr
Ang mas dalisay na metal ay nakuha sa pamamagitan ng electrolysis ng mga puro solusyon ng mga chromium compound.
^ Mga katangiang pisikal
Ang Chrome ay isang steel-gray na metal, matigas, medyo mabigat. ( = 7.19 g/cm 3), plastik, malleable, natutunaw sa 1890°C, kumukulo sa 2480°C. Ito ay nangyayari sa kalikasan bilang pinaghalong apat na matatag na isotopes na may mass number na 50, 52, 53 at 54. Ang pinakakaraniwang isotope ay 52 Cr (83.76%).
Mga katangian ng kemikal
Ang pag-aayos ng mga electron sa 3d at 4s orbitals ng chromium atom ay maaaring katawanin ng diagram:

Ipinapakita nito na ang chromium ay maaaring magpakita ng iba't ibang estado ng oksihenasyon sa mga compound mula +1 hanggang +6; Sa mga ito, ang pinaka-matatag ay mga chromium compound na may mga estado ng oksihenasyon na +2, +3, +6. Kaya, hindi lamang ang s-electron ng panlabas na antas, kundi pati na rin ang limang d-electron ng pre-external na antas ay lumahok sa pagbuo ng mga bono ng kemikal.
Sa normal na kondisyon, ang chromium ay lumalaban sa oxygen, tubig, at ilang iba pang kemikal. Sa mataas na temperatura, ang chromium ay nasusunog sa oxygen:
4Cr+3O 2 =2Cr 2 O 3
Kapag pinainit, ito ay tumutugon sa singaw ng tubig:
2Cr+3H 2 O=Cr 2 O 3 +3H 2
Kapag pinainit, ang chromium metal ay tumutugon din sa mga halogens, sulfur, nitrogen, phosphorus, carbon, silicon at boron. Halimbawa: 2Cr+N 2 =2CrN 2Cr+3S=Cr 2 S 3 Cr+2Si=CrSi 2
Ang metal ay natutunaw sa ordinaryong temperatura sa dilute acids (HCl, H 2 SO 4) kasama ang paglabas ng hydrogen. Sa mga kasong ito, sa kawalan ng hangin, nabuo ang mga chromium (II) na asin:
Cr+2HCl=CrCl2+H 2 At sa hangin - chromium (III) salts: 4Cr+12НCl+3О 2 =4CrСl+6Н 2 O
Kung ang metal ay nahuhulog sa loob ng ilang oras sa nitric acid (puro o diluted), pagkatapos ay titigil itong matunaw sa HCl at H 2 SO 4, hindi nagbabago kapag pinainit ng mga halogens, atbp. Ang hindi pangkaraniwang bagay na ito - passivation - ay ipinaliwanag sa pamamagitan ng pagbuo ng isang proteksiyon na layer sa ibabaw ng metal - isang napaka siksik at mekanikal na malakas (kahit na napaka manipis) na pelikula ng chromium oxide Cr 2 O 3.
Aplikasyon
Ang pangunahing mamimili ng chromium ay metalurhiya. Sa pagdaragdag ng chromium, ang bakal ay nagiging mas lumalaban sa mga kemikal na reagents; Ang mga mahahalagang katangian ng bakal tulad ng lakas, tigas at paglaban sa pagsusuot ay tumataas din. Ang electrolytic coating ng mga produktong bakal na may chromium (chrome plating) ay nagbibigay din sa kanila ng corrosion resistance.
Ang pamilya ng chromium alloys ay napakalaki. Nichrome (alloys na may nickel) at pilay (may aluminyo at bakal) ay lumalaban
Ang chivas ay may mataas na resistensya at ginagamit upang gumawa ng mga heater sa mga electric resistance furnace. Stellite - isang haluang metal ng chromium (20-25%), kobalt (45-60%), tungsten (5-20%), bakal (1-3%) - napakahirap, lumalaban sa pagsusuot at kaagnasan; ginagamit sa industriya ng pagpoproseso ng metal para sa paggawa ng mga tool sa paggupit. Ginagamit ang mga bakal na Chrome-molybdenum upang lumikha ng mga fusel ng sasakyang panghimpapawid.
^ 17.3. Chromium (II), (III) at (VI) oxides
Ang Chromium ay bumubuo ng tatlong oxide: CrO, Cr 2 O 3, CrO 3.
Ang Chromium (II) oxide CrO ay isang pyrophoric black powder. May mga pangunahing katangian.
Sa mga reaksyon ng redox ito ay kumikilos bilang isang ahente ng pagbabawas:

Ang CrO ay nakukuha sa pamamagitan ng agnas ng chromium carbonyl Cr(CO) 6 sa vacuum sa 300°C.
Ang Chromium (III) oxide Cr 2 O 3 ay isang refractory green powder. Ito ay malapit sa corundum sa tigas, kaya naman ito ay kasama sa mga ahente ng buli. Nabuo sa pamamagitan ng interaksyon ng Cr at O 2 sa mataas na temperatura. Sa laboratoryo, ang chromium(III) oxide ay maaaring ihanda sa pamamagitan ng pag-init ng ammonium dichromate:
(N -3 H 4) 2 Cr +6 2 O 7 =Cr +3 2 O 3 +N 0 2 +4H 2 O
Ang Chromium(III) oxide ay may amphoteric properties. Kapag nakikipag-ugnayan sa mga acid, ang mga chromium (III) na asin ay nabuo: Cr 2 O 3 +3H 2 SO 4 =Cr 2 (SO 4) 3 +3H 2 O
Kapag nakikipag-ugnayan sa alkalis sa pagkatunaw, ang mga chromium (III) compound ay nabuo - chromites (sa kawalan ng oxygen): Cr 2 O 3 + 2NaOH = 2NaCrO 2 + H 2 O
Ang Chromium(III) oxide ay hindi matutunaw sa tubig.
Sa mga reaksiyong redox, ang chromium (III) oxide ay kumikilos bilang isang ahente ng pagbabawas:

Ang Chromium (VI) oxide CrO 3 - chromic anhydride, ay isang madilim na pulang kristal na hugis karayom. Kapag pinainit sa halos 200°C, nabubulok ito:
4CrO 3 =2Cr 2 O 3 +3O 2
Madaling natutunaw sa tubig, bilang acidic sa kalikasan, ito ay bumubuo ng mga chromic acid. Sa labis na tubig, ang chromic acid H 2 CrO 4 ay nabuo:
CrO 3 +H 2 O=H 2 CrO 4
Sa isang mataas na konsentrasyon ng CrO 3, nabuo ang dichromic acid H 2 Cr 2 O 7:
2CrO 3 +H 2 O=H 2 Cr 2 O 7
Na, kapag natunaw, nagiging chromic acid:
H 2 Cr 2 O 7 +H 2 O=2H 2 CrO 4
Ang mga chromic acid ay umiiral lamang sa may tubig na solusyon; Gayunpaman, ang kanilang mga asin ay napakatatag.
Ang Chromium(VI) oxide ay isang malakas na oxidizing agent:
3S+4CrO 3 =3SO 2 +2Cr 2 O 3
Nag-oxidize ng yodo, sulfur, phosphorus, coal, nagiging Cr 2 O 3. Ang CrO 3 ay nakukuha sa pamamagitan ng pagkilos ng labis na concentrated sulfuric acid sa isang saturated aqueous solution ng sodium dichromate: Na 2 Cr 2 O 7 +2H 2 SO 4 =2CrO 3 +2NaHSO 4 +H 2 O Dapat tandaan na ang chromium Ang (VI) oxide ay lubhang nakakalason.
^ 17.4. Hydroxides at salts ng chromium (II) at (III). Mga kumplikadong compound ng Chromium(III).
Ang Chromium (II) hydroxide Cr(OH) 2 ay nakuha sa anyo ng isang dilaw na namuo sa pamamagitan ng paggamot sa mga solusyon ng chromium (II) salts na may alkalis sa kawalan ng oxygen:
CrСl 2 +2NaOH=Cr(OH) 2 +2NaCl
Ang Cr(OH) 2 ay may tipikal na mga pangunahing katangian at isang malakas na ahente ng pagbabawas:
2Cr(OH) 2 +H 2 O+1/2O 2 =2Cr(OH) 3
Ang mga may tubig na solusyon ng chromium (II) salts ay nakukuha nang walang access sa hangin sa pamamagitan ng pagtunaw ng chromium metal sa dilute acids sa hydrogen atmosphere o sa pamamagitan ng pagbabawas ng trivalent chromium salts na may zinc sa acidic na kapaligiran. Ang mga anhydrous salts ng chromium (II) ay puti, at ang mga aqueous solution at crystalline hydrates ay asul.
Sa kanilang mga kemikal na katangian, ang chromium (II) salts ay katulad ng divalent iron salts, ngunit naiiba sa huli sa mas malinaw na pagbabawas ng mga katangian, i.e. ay mas madaling ma-oxidized kaysa sa katumbas na ferrous iron compounds. Ito ang dahilan kung bakit napakahirap kumuha at mag-imbak ng mga divalent chromium compound.
Ang Chromium (III) hydroxide Cr(OH) 3 ay isang gelatinous precipitate ng gray-green na kulay, ito ay nakuha sa pamamagitan ng pagkilos ng alkalis sa mga solusyon ng chromium (III) salts:
Cr 2 (SO 4) 3 +6NaOH=2Cr(OH) 3 +3Na 2 SO 4
Ang Chromium (III) hydroxide ay may mga katangian ng amphoteric, na natutunaw pareho sa mga acid upang bumuo ng mga chromium (III) na asin:
2Cr(OH) 3 +3H 2 SO 4 =Cr 2 (SO 4) 3 +6H 2 O at sa alkalis na may pagbuo ng hydroxychromites: Cr(OH) 3 +NaOH=Na 3
Kapag ang Cr(OH) 3 ay pinagsama sa alkalis, nabuo ang metachromites at orthochromites:
Cr(OH) 3 +NaOH=NaCrO 2 +2H 2 O Cr(OH) 3 +3NaOH=Na 3 CrO 3 +3H 2 O
Kapag ang chromium (III) hydroxide ay na-calcine, ang chromium (III) oxide ay nabuo:
2Cr(OH) 3 =Cr 2 O 3 +3H 2 O
Ang mga asin ng trivalent chromium, pareho sa solid state at sa may tubig na mga solusyon, ay may kulay. Halimbawa, ang anhydrous chromium (III) sulfate Cr 2 (SO 4) 3 ay violet-red ang kulay ng mga aqueous solution ng chromium (III) sulfate, depende sa mga kondisyon, ay maaaring magbago ng kulay mula sa purple hanggang berde. Ito ay ipinaliwanag sa pamamagitan ng katotohanan na sa may tubig na mga solusyon ang Cr 3+ cation ay umiiral lamang sa anyo ng isang hydrated 3+ ion dahil sa pagkahilig ng trivalent chromium na bumuo ng mga kumplikadong compound. Ang lilang kulay ng mga may tubig na solusyon ng chromium (III) na mga asing-gamot ay tiyak na dahil sa 3+ cation. Kapag pinainit, ang chromium(III) complex salts ay maaaring
Bahagyang nawalan ng tubig, na bumubuo ng mga asing-gamot ng iba't ibang kulay, kahit berde.
Ang mga trivalent chromium salt ay katulad ng mga aluminyo na asing-gamot sa komposisyon, istraktura ng kristal na sala-sala, at solubility; Kaya, para sa chromium (III), pati na rin para sa aluminyo, ang pagbuo ng chromium-potassium alum KCr(SO 4) 2 12H 2 O ay karaniwang ginagamit para sa pangungulti ng balat at bilang isang mordant sa mga tela.
Chromium salts (III) Cr 2 (SO 4) 3, CrCl 3, atbp. matatag kapag nakaimbak sa hangin, ngunit napapailalim sa hydrolysis sa mga solusyon:
Cr 3+ +3Сl - +ННCr(ОН) 2+ +3Сl - +Н +
Ang hydrolysis ay nangyayari sa yugto I, ngunit may mga asin na ganap na na-hydrolyzed:
Cr 2 S 3 +H 2 O=Cr(OH) 3 +H 2 S
Sa mga reaksiyong redox sa isang alkaline na kapaligiran, ang mga chromium (III) na asin ay kumikilos bilang mga ahente ng pagbabawas:

Dapat pansinin na sa serye ng mga chromium hydroxides ng iba't ibang mga estado ng oksihenasyon Cr(OH) 2 - Cr(OH) 3 - H 2 CrO 4, ang mga pangunahing katangian ay natural na humina at ang acidic na mga katangian ay pinalakas. Ang pagbabagong ito sa mga katangian ay dahil sa pagtaas ng antas ng oksihenasyon at pagbaba sa ionic radii ng chromium. Sa parehong serye, ang mga katangian ng oxidizing ay patuloy na pinahusay. Ang mga compound ng Cr (II) ay malakas na mga ahente ng pagbabawas at madaling ma-oxidized, na nagiging mga chromium (III) compound. Ang Chromium(VI) compounds ay malakas na oxidizing agent at madaling nababawasan sa chromium(III) compounds. Mga compound na may intermediate na estado ng oksihenasyon, i.e. Ang mga compound ng chromium (III) ay maaaring, kapag nakikipag-ugnayan sa mga malakas na ahente ng pagbabawas, ay nagpapakita ng mga katangian ng pag-oxidizing, nagiging mga compound ng chromium (II), at kapag nakikipag-ugnayan sa mga malakas na ahente ng pag-oxidize, nagpapakita ng mga katangian ng pagbabawas, nagiging mga compound ng chromium (VI).
^ 17.5. Chromates at dichromates
Ang mga Chromic acid ay bumubuo ng dalawang serye ng mga compound: chromates - ang tinatawag na salts ng chromic acid, at dichromates - ang tinatawag na salts ng dichromic acid. Ang mga Chromate ay may kulay na dilaw (ang kulay ng chromate ion CrO 2-4), ang mga dichromate ay may kulay na orange (ang kulay ng dichromate ion Cr 2 O 2-7) .
Ang mga Chromate at dichromate ay naghihiwalay, na bumubuo ng mga chromate at dichromate ions, ayon sa pagkakabanggit:
K 2 CrO 4 2K + +CrO 2- 4
K 2 Cr 2 O 7 2K + +Cr 2 O 2- 7
Ang mga Chromate ay nakukuha sa pamamagitan ng pagtugon sa CrO 3 na may alkalis:
CrO 3 +2NaOH=Na 2 CrO 4 +H 2 O
Ang mga dichromate ay nabuo sa pamamagitan ng pagdaragdag ng mga acid sa chromates:
2Na 2 CrO 4 +H 2 SO 4 =Na 2 Cr 2 O 7 +Na 2 SO 4 +H 2 O
Posible rin ang reverse transition kapag nagdadagdag ng alkalis sa mga solusyon ng dichromates:
Na 2 Cr 2 O 7 +2NaOH=2Na 2 CrO 4 +H 2 O
Kaya, sa mga acidic na solusyon, ang mga dichromate ay higit na umiiral (kulayan nila ang solusyon ng orange), at sa mga alkalina na solusyon, ang mga chromate (dilaw na solusyon) ay umiiral. Ang equilibrium sa chromate-dichromate system ay maaaring katawanin ng sumusunod na equation sa pinababang ionic form:
2CrO 2- 4 +2H + Cr 2 O 2- 7 +H 2 O Cr 2 O 2- 7 +2OH - 2CrO 2- 4 +H 2 O
Ang mga asin ng chromic acid sa isang acidic na kapaligiran ay malakas na oxidizing agent. Karaniwang binabawasan ang mga ito sa mga chromium(III) compound, halimbawa:

Aplikasyon
Ang mga compound ng Chromium (VI) ay lubhang nakakalason: nakakaapekto ang mga ito sa balat, respiratory tract, at nagiging sanhi ng pamamaga ng mga mata. Sa mga laboratoryo, ang pinaghalong chromium ay kadalasang ginagamit para sa paghuhugas ng mga kemikal na babasagin.
Na binubuo ng pantay na dami ng isang saturated aqueous solution ng K 2 Cr 2 O 7 at puro H 2 SO 4.
Ang sodium at potassium chromates na natutunaw sa tubig ay ginagamit sa paggawa ng tela at katad bilang mga preservative ng kahoy. Ang mga hindi matutunaw na chromates ng ilang mga metal ay mahusay na artistikong mga pintura. Ito ay mga dilaw na korona (PbCrO 4, | ZnCrO 4, SrCrO 4), at pulang lead-molybdenum na korona (naglalaman ng PbCrO 4 at MoCrO 4) at marami pang iba. Ang SnCrO 4 ay sikat sa kayamanan ng mga shade - mula pink-red hanggang violet, na ginagamit sa pagpipinta ng porselana.