Карактеристики на елементите од главната подгрупа од III група. Појава во природата Хемиски својства на групата 3 од главната подгрупа
Во периодниот систем се познати 30 p - елементи, тоа се елементи лоцирани во групите III-A - VIII-A. Во p-елементите, p-поднивото на надворешното електронско ниво е исполнето со електрони.
III-A група – B, Al, Ga, In, Tl – се карактеризираат со присуство на 3 електрони во надворешниот електронски слој на атомот, при што борот на надворешниот слој на атомот има 2 електрони, алуминиумот има 8 електрони, Ga, In, Tl – 18 електрони. Групата III е најинтензивна на елементи - содржи 37 елементи, вклучувајќи лантаниди и актиниди. Сите елементи се метали, со исклучок на бор.
Кога се оди од Al до Ga, атомскиот радиус се намалува. Ова се должи на фактот дека во Ga полнењето на p-поднивото започнува откако ќе се пополни 3d 10 електронската обвивка. Под влијание на 3d 10 - електрони, електронската обвивка на целиот атом е компресирана и големината на атомот се намалува (d - ефект на компресија).
Не е забележана монотона (секвенцијална) промена на металните својства. Металните својства нагло се зголемуваат кога се движат од бор на алуминиум, малку слабеат во галиумот и постепено повторно се зголемуваат кога се движат кон талиум. Ова се должи на фактот дека електронската обвивка на атомот Ga е компресирана поради d-електрони (d-компресија ефект In, Tl (за разлика од B и Al) секој содржи 18 електрони во претпоследниот слој. Затоа, линеарната промена на својствата (стаорец, Tmelt итн.) од Al во Ga е нарушена.
Точката на вриење природно се намалува од B до Tl. Точката на топење е неправилна поради структурните карактеристики на кристалната решетка.
Најтоплив метал е Ga (Tm = 29,8˚C).
Во невозбудена состојба, конфигурација на надворешниот слој ns 2 np 1, во возбудена состојба - ns 1 np 2.
Во невозбудена состојба има 1 неспарен електрон, меѓутоа, соединенијата на повеќето од овие елементи, во кои нивната оксидациска состојба е +1, се многу нестабилни и оксидационата состојба +3 во возбудена состојба е најкарактеристична за нив, бидејќи Потребна е малку енергија за пренос на електрон од s-состојба во состојба p.
B е неметал, Al сè уште не е типичен метал, Ga, In, Tl се типични метали. Соединенија: EN 3, E 2 O 3, E(OH) 3.
Хидридите на елементите се условни, бидејќи состојбата на оксидација на елементите е позитивна, а на водородот е негативна
B 2s 2 2p 1 B 2 H 6
Al 3s 2 3p 1 (AlH 3) nGa 4s 2 4p 1 (GaH 3) n
Во 5s 2 5p 1 (InH 3) n
Tl 6s 2 6p 1 TlH 3
E 2 O 3 -општа формула на оксиди, има различен карактер
Б2О3киселински оксид
Al2O3амфотеричен оксид
Ga2O3
Во 2 O 3амфотеричен оксид (со доминација на основните својства)
Tl 2 O(Tl 2 O 3) основен оксид
E(OH) 3 -хидроксиди, доаѓа до премин од кисели, преку амфотерни во базни хидроксиди.
|
Al(OH) 3амфотеричен хидроксид
Ga(OH)3амфотеричен хидроксид
Во (OH) 3амфотеричен хидроксид
TlOHосновен хидроксид
Тие формираат соединенија со халогени EG 3, сулфур E 2 S 3, азот EN.
Хемијата на кислородните соединенија на бор и силициум има многу заедничко: киселата природа на оксидите и хидроксидите, способноста да се формираат бројни полимерни структури и стаклено формирање на оксиди.
Бор. Потврда. Хемиски својства
Борот во неговите својства е најсличен со силиконот од групата IV-A елемент („дијагонална сличност“).
Борот е кристална материја со црна боја, огноотпорна на t = 2300 C.
Двете најчести модификации на бор се аморфни и кристални. Аморфната модификација е најреактивна.
Добивање на бор
1. Термичко разложување на борните хидриди:
B 2 H 6 2B + 3H 2
2. Термички магнезиум бор оксид:
B 2 O 3 + 3Mg 3MgO + 2B
B 2 O 3 + 3Zn 3ZnO + 2B
3. Од бор хлорид:
2BCl 3 + 3Zn 3ZnCl 2 + 2B
Борот директно реагира само со флуор, но по загревањето комуницира со кислород, азот и јаглерод.
B + 2F 2 → BF 4
4B + 3O 2 2B 2 O 3
2B + N 2 2BN
4B + 3C B 4 C 3
Борот реагира со топли концентрирани киселини H 2 SO 4 и HNO 3
2B + 3H 2 SO 4 конц. → 2H 3 BO 3 + 3SO 2
B + 3HNO 3 конц. → H 3 BO 3 + 3NO 2
Реагира со алкалии само во присуство на силни оксидирачки агенси:
2B + 2NaOH + 3H 2 O 2 → 2NaBO 2 + 4H 2 O
Сепак, аморфниот бор може да реагира со алкали кога се вари:
2B аморфни + 2NaOH 2NaBO 2 + H2
3SiO 2 + 4B → 3Si + 2B 2 O 3
Борски халиди
BF 3 BCl 3 BBr 3 BI 3
гас гас течна цврста
Е врска kJ 644 443 376 284
Отпорноста паѓа
BCl 3 се формира преку интеракција на три електрони на атом на бор во возбудена состојба. Се формираат три врски според спин-валентниот (разменувачки) механизам.
Јонот има тетраедрална структура
Боронските халиди се со кисела природа и хидролизираат:
BCl 3 + 3H 2 O → H 3 BO 3 + 3HCl
BF 4 + HF → H(јака киселина)
Киселините халиди реагираат со основните халиди:
ВФ 3 + NaF = Na
Борот не реагира директно со водородот. Борните хидриди се добиваат не со директна интеракција со водород, туку индиректно.
На пример, дејството на хлороводородна киселина на магнезиум борид.
Mg 3 B 2 + 6HCl ® B 2 H 6 + 3 MgCl 2
Резултатот е мешавина од борохидриди (борани). Бораните се познати во гасовити, течни и цврсти форми.
B 2 H 6– диборан – гас
B 4 H 10 -тетраборан - течност
B 10 N 14– тврд боран.
Имаат непријатен мирис и се многу отровни. Повеќето од нив самозапалуваат и се распаѓаат со вода.
2B 4 H 10 + 11 O 2 = 4B 2 O 3 + 10 H 2 O
B 2 H 6 + 6 H 2 O = 2H 3 VO 3 + 6H 2
Во молекулите на борохидрид, атомите на бор се поврзани со водородни „мостови“.

Бораните се посебен вид на соединение тие формираат врска со дефицит на електрони. Нивните молекули содржат помалку електрони отколку што е потребно за да се формираат двоелектронски врски. Оваа таканаречена „банана врска“ е формирана како резултат на преклопување на две sp 3 хибридни орбитали на атоми на бор и една s орбитала на атом на водород. Секој премостувачки водороден атом формира заедничка двоелектронска трицентрична B–H–B врска со два атоми на бор.
Соединенијата со дефицит на електрони се акцептори на електрони. Шеми за термичко распаѓање на ортоборна киселина:
H 3 BO 3 « HBO 2 + H 2 O
4NVO 2 « 2B 2 O 3 + 2H 2 O
За разлика од обичните киселини, ортоборната киселина не го апстрахира H+, туку предизвикува промена во дисоцијациската рамнотежа на водата, додавајќи OH- поради интеракцијата донор-акцептор, делувајќи како монобазичен.
B(OH) 3 + H 2 O → B(OH) 4 - + H + Kd = 5,8 10 -10
Координативниот број на бор со кислород е 3, така што кислородните соединенија на борот формираат полимерни соединенија (полиборати).
Сите киселини се претвораат во ортоборна киселина:
HBO 2 + H 2 O → H 3 BO 3
H 2 B 4 O 7 + 5H 2 O → 4H 3 BO 3
Ако ортоборната киселина е најстабилна киселина, тогаш нејзините соли не постојат во обични услови во споредба со солите на мета- и тетраборните киселини. Така, кога растворот на борна киселина е изложен на натриум хидроксид, резултатот не е ортоборат (не постои во растворот), туку натриум тетраборат (со недостаток на NaOH) или метаборат (со вишок на NaOH):
2NaOH wk + 4H 3 BO 3 = Na 2 B 4 O 7 + 7 H 2 O
NaOH ex + H 3 BO 3 = NaBO 2 + 2H 2 O
Кога има вишок на алкали, добиениот натриум тетраборат се претвора во натриум метаборат:
Na 2 B 4 O 7 + 2NaOH ex = 4NaBO 2 + H 2 O
Киселината хидролиза на натриум тетраборат доведува до формирање на ортоборна киселина:
Na 2 B 4 O 7 + 2HCl + 5 H 2 O = 2NaCl + 4 H 3 BO 3
Алуминиум
Неговите метални својства се поизразени од оние на борот. Хемиските врски на алуминиумот со други метали се главно од ковалентна природа. Вид на кристална структура - hcp.
За разлика од борот, алуминиумскиот атом има слободни d-поднивоа на надворешното ниво. Al 3+ има мал радиус и прилично висок полнеж, поради што е комплексен агенс со координативен број 4 или 6. Соединенијата на Al се постабилни од борот.
Производство на алуминиум
Во индустријата, Al се произведува со електролиза на стопен Al 2 O 3 во криолит (Na 3 AlF 6)
Al 2 O 3 → Al +3 + AlO 3 -3
K (-) Al +3 + 3e = Al 0
A (+) 2AlO 3 -3 – 6e = Al 2 O 3 + O 2
Ga, In, Tl се елементи во трагови кои се наоѓаат во оксидните и сулфидните руди. Во овој случај, соодветните соединенија се концентрирани и дејствуваат како редуцирачки агенси.
E 2 O 3 + 3H 2 → 2E + 3H 2 O
E 2 O 3 + 3CO → 2E + 3CO 2
Алуминиумот е во главната подгрупа од групата III од периодниот систем. На надворешното енергетско ниво на алуминиумскиот атом има слободни p-орбитали, што му овозможува да оди во возбудена состојба. Во возбудена состојба, алуминиумскиот атом формира три ковалентни врски или целосно донира три валентни електрони, покажувајќи состојба на оксидација од +3.
Алуминиумот е најчестиот метал на Земјата : неговиот масен удел во земјината кора е 8,8%. Најголемиот дел од природниот алуминиум е дел од алумосиликати - супстанции чии главни компоненти се силициум и алуминиум оксиди.
Алуминиумот е светло сребрено-бел метал, се топи на 600°C, е многу еластичен, лесно се вовлекува во жица и се валани во листови и фолија. Во однос на електричната спроводливост, алуминиумот е втор само по среброто и бакарот.
Интеракција со едноставни супстанции:
1) со халогени:
2Al + 3Cl 2 = 2AlCl 3
2) со кислород:
4Al + 3O 2 = 2Al 2 O 3
3) со сулфур:
2Al + 3S = Al 2 S 3
4) со азот:
Алуминиумот не реагира директно со водородот, но неговиот хидрид AlH3 се добива индиректно.
Интеракција со сложени супстанции:
1) со киселини:
2Al + 6HCl = 2AlCl3 + 3H2
2) со алкалии:
2Al + 2NaOH + 6H 2 O = 2Na + 3H 2
Ако NaOH е цврст:
2Al + 2NaOH + 6H2O = 2NaAlO2 + 3H2
3) со вода:
2Al + 6H2O = 2Al(OH) 3 + 3H2
Својства на алуминиум оксид и хидроксид:Алуминиум оксид, или алумина, Al 2 O 3 е бел прав. Алуминиум оксид може да се произведе со согорување на метал или калцинирање на алуминиум хидроксид:
2Al(OH)3 = Al 2 O 3 + 3H 2 O
Алуминиум оксид е практично нерастворлив во вода. Хидроксидот Al(OH) 3 што одговара на овој оксид се добива со дејство на амониум хидроксид или раствори на алкалии, земени во недостаток, на раствори на алуминиумски соли:
AlCl 3 + 3NH 3 H2O = Al(OH)3 + 3NH4Cl
Оксидот и хидроксидот на овој метал се амфотеричен,тие. покажуваат и основни и кисели својства.
Основни својства:
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O
2Al(OH) 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 6H 2 O
Карактеристики на киселина:
Al 2 O 3 + 6KOH + 3H 2 O = 2K 3
2Al(OH) 3 + 6KOH = K3
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Алуминиум добиеелектролитски метод. Не може да се изолира од водени раствори на соли, бидејќи е многу активен метал. Затоа, главниот индустриски метод за производство на алуминиум метал е електролиза на топење што содржи алуминиум оксид и криолит.
Алуминиумскиот метал е широко користен во индустријата и е на второ место по обем на производство по железото. Најголемиот дел од алуминиумот се користи за производство на легури:
Дуралумин - легура на алуминиум што содржи бакар и мали количини на магнезиум, манган и други компоненти. Duralumins се лесни, издржливи и отпорни на корозија легури. Се користи во авиони и машинско инженерство.
Магналин - легура на алуминиум и магнезиум. Се користи во авиони и машинско инженерство, во градежништвото. Отпорен е на корозија во морската вода, поради што се користи во бродоградба. Силумин е алуминиумска легура која содржи силикон. Добро лиење. Оваа легура се користи во автомобилите, авионите и машинското инженерство и во производството на прецизни инструменти. Алуминиумот е еластичен метал, па од него се прави тенка фолија, која се користи за производство на радио инженерски производи и за пакување стоки. Жиците и сребрените бои се направени од алуминиум.
Испратете ја вашата добра работа во базата на знаење е едноставна. Користете ја формата подолу
Студентите, дипломираните студенти, младите научници кои ја користат базата на знаење во нивните студии и работа ќе ви бидат многу благодарни.
Објавено на http://www.allbest.ru/
Третата група од периодичниот систем опфаќа многу голем број хемиски елементи, бидејќи неговиот состав, покрај елементите на главните и секундарните подгрупи, вклучува елементи со сериски броеви 58-71 (лантаниди) и со сериски броеви 90-103 ( актиниди). Ќе ги разгледаме лантанидите и актинидите заедно со елементите од нивната секундарна подгрупа. алуминиум галиум индиум
Елементите на главната подгрупа од третата група - бор, алуминиум, галиум, индиум и талиум - се карактеризираат со присуство на три електрони во надворешниот електронски слој на атомот.
Алуминиумот е главниот претставник на металите од главната подгрупа од групата III од Периодниот систем. Својствата на неговите аналози - галиум, индиум и талиум - личат на својствата на алуминиумот, бидејќи сите овие елементи имаат иста електронска конфигурација на надворешното ниво ns 2 nр 1 и можат да покажат +3 оксидациона состојба.
Електронска структура на елементи од главната подгрупаIIIгрупи
Сите елементи од групата се тривалентни, но со зголемување на атомскиот број, валентноста 1 станува покарактеристична (Tl е претежно едновалентна).
Во серијата B--Al--Ga--In--Tl, киселоста се намалува и базичноста на хидроксидите R(OH) 3 се зголемува. H 3 VO 3 е киселина, Al(OH) 3 и Ga(OH) 3 се амфотерни бази, In(OH) 3 и Tl(OH) 3 се типични бази. ТlON е силна основа.
Следно, ќе ги разгледаме својствата на елементите: детално - алуминиум, како типичен претставник на п-метали, исклучително широко користен во пракса, бор, како претставник на „полуметали“ и покажува аномални својства во споредба со сите други елементи од подгрупата.
Алуминиумот е најчестиот метал на Земјата (трето место меѓу сите елементи; 8% од составот на земјината кора). Во природата не се јавува како слободен метал; е дел од алумина (Al 2 O 3), боксит (Al 2 O 3 * xH 2 O). Покрај тоа, алуминиумот се наоѓа како силикати во карпите како глина, мика и фелдспат.
Физички својства.
Алуминиумот во својата слободна форма е сребрено-бел метал со висока топлинска и електрична спроводливост. Алуминиумот има мала густина - околу три пати помала од онаа на железо или бакар, а во исто време е издржлив метал.
Борот постои во неколку алотропни модификации. Аморфниот бор е темно кафеав прав. Кристалниот бор е сиво-црн, со метален сјај. Во однос на цврстината, кристалниот бор е на второ место (по дијамантот) меѓу сите супстанции. На собна температура, борот е лош спроводник на електрична енергија; исто како силиконот, има полупроводнички својства.
Хемиски својства.
Површината на алуминиумот обично е покриена со издржлив филм од Al 2 O 3 оксид, кој го штити од интеракција со околината. Ако овој филм се отстрани, металот може енергично да реагира со вода:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 ^.
Во форма на струготини или прав, светло гори во воздухот, ослободувајќи голема количина топлина:
2Al + 3/2O 2 = Al 2 O 3 + 1676 kJ.
Оваа околност се користи за добивање на одреден број метали од нивните оксиди со алуминотермија. Така се нарекува редукцијата со алуминиум во прав на оние метали чија топлина на формирање на оксиди е помала од топлината на формирање на Al 2 O 3, на пример:
Cr 2 O 3 + 2Al = 2Cr + Al 2 O 3 + 539 kJ.
Борот, за разлика од алуминиумот, е хемиски инертен (особено кристален). Така, тој реагира со кислород само на многу високи температури (> 700°C) со формирање на борен анхидрид B 2 O 3:
2B + ZO 2 = 2B 2 O 3,
Борот во никој случај не реагира со вода. На уште повисока температура (> 1200°C) реагира со азот, давајќи бор нитрид (кој се користи за производство на огноотпорни материјали):
Борот реагира само со флуор на собна температура, додека реакциите со хлор и бром се случуваат само со силно загревање (400 и 600 °C, соодветно); во сите овие случаи, тој формира BHal 3 трихалиди - испарливи течности кои испаруваат во воздухот и лесно се хидролизираат со вода:
2B + 3Hal 2 = 2BAl 3.
Како резултат на хидролиза, се формира ортоборна (борна) киселина H 3 BO 3:
VNal 3 + 3H 2 O = H 3 VO 3 + ZNNAl.
За разлика од борот, алуминиумот веќе на собна температура активно реагира со сите халогени, формирајќи халиди. Кога се загрева, тој реагира со сулфур (200 °C), азот (800 °C), фосфор (500 °C) и јаглерод (2000 °C):
2Al + 3S = Al 2 S 3 (алуминиум сулфид),
2Al + N 2 = 2AlN (алуминиум нитрид),
Al + P = AlP (алуминиум фосфид),
4Al + 3C = Al 4 C 3 (алуминиум карбид).
Сите овие соединенија се целосно хидролизирани за да формираат алуминиум хидроксид и, соодветно, водород сулфид, амонијак, фосфин и метан.
Алуминиумот лесно се раствора во хлороводородна киселина од која било концентрација:
2Al + 6HCl = 2AlCl 3 + ZH 2 ^.
Концентрираните сулфурни и азотни киселини немаат ефект врз алуминиумот на студ. Кога се загрева, алуминиумот може да ги намали овие киселини без да ослободува водород:
2Al + 6H 2 SO 4 (конц) = Al 2 (SO 4) 3 + 3SO 2 + 6H 2 O,
Al + 6HNO 3(conc) = Al(NO 3) 3 + 3NO 2 + 3H 2 O.
Алуминиумот се раствора во разредена сулфурна киселина, ослободувајќи водород:
2Al + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2.
Во разредена азотна киселина, реакцијата продолжува со ослободување на азотен оксид (II):
Al + 4HNO 3 = Al(NO 3) 3 + NO + 2H 2 O.
Алуминиумот се раствора во раствори на алкали и карбонати на алкални метали за да формира тетрахидроксиалуминати:
2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4] + 3H 2 ^.
Киселините кои не се оксидирачки агенси не реагираат со бор и само концентрираниот HNO 3 го оксидира до борна киселина:
B + HNO3(conc) + H2O = H3BO3 + NO^.
Галиум(лат. Галиум), Ga, хемиски елемент од групата III од периодичниот систем на Д.И., сериски број 31, атомска маса 69,72; сребрено-бел мек метал. Се состои од два стабилни изотопи со масени броеви 69 (60,5%) и 71 (39,5%).
Постоењето на Галиум („ека-алуминиум“) и неговите основни својства беа предвидени во 1870 година од страна на Д.И. Елементот бил откриен со спектрална анализа во пиринеја цинкова мешавина и изолиран во 1875 година од францускиот хемичар P. E. Lecoq de Boisbaudran; именувана по Франција (лат. Галија). Точното совпаѓање на својствата на Галиум со оние предвидените беше првиот триумф на периодичниот систем.
Просечната содржина на галиум во земјината кора е релативно висока, 1,5·10 -3% по маса, што е еднакво на содржината на олово и молибден. Галиумот е типичен микроелемент. Единствениот минерал на Галиум, галит CuGaS 2, е многу редок. Геохемијата на галиумот е тесно поврзана со геохемијата на алуминиумот, што се должи на сличноста на нивните физичко-хемиски својства. Главниот дел од галиумот во литосферата е содржан во алуминиумските минерали. Содржината на галиум во бокситите и нефелините се движи од 0,002 до 0,01%. Зголемени концентрации на галиум се забележуваат и кај сфалеритите (0,01-0,02%), во тврдиот јаглен (заедно со германиум), како и во некои железни руди.
Физички својства на галиум.Галиумот има орторомбна (псевдотетрагонална) решетка со параметри a = 4,5197E, b = 7,6601E, c = 4,5257E. Густината (g/cm3) на цврст метал е 5,904 (20°C), течниот метал е 6,095 (29,8°C), односно кога се зацврстува, волуменот на галиумот се зголемува; температура на топење 29,8°C, температура на вриење 2230°C. Карактеристична карактеристика на Галиум е голем опсег на течна состојба (2200°C) и низок парен притисок на температури до 1100-1200°C. Специфичниот топлински капацитет на цврстиот галиум е 376,7 J/(kg K), односно 0,09 cal/(g deg) во опсег од 0-24°C, на течен галиум, соодветно, 410 J/(kg K ), односно 0,098 cal /(g deg) во опсег од 29-100°C. Електричната отпорност (ом cm) на цврстиот галиум е 53,4·10 -6 (0°C), течноста 27,2·10-6 (30°C). Вискозитет (поим = 0,1 n sec/m2): 1,612 (98°C), 0,578 (1100°C), површински напон 0,735 n/m (735 dyne/cm) (30°C во H2 атмосфера). Коефициентите на рефлексија за бранови должини 4360E и 5890E се 75,6% и 71,3%, соодветно. Термички пресек за зафаќање на неутрони е 2,71 штали (2,7·10 -28 m2).
Хемиски својства на галиум.
Галиумот е стабилен во воздухот на обични температури. Над 260°C, бавна оксидација се забележува во сув кислород (филмот оксид го штити металот). Галиумот полека се раствора во сулфурна и хлороводородна киселина, брзо во флуороводородна киселина и е стабилен на студ во азотна киселина. Галиумот полека се раствора во топли алкални раствори. Хлорот и бромот реагираат со Галиум на студ, јод - кога се загрева. Растопениот галиум на температури над 300°C е во интеракција со сите структурни метали и легури.
Најстабилни се тривалентни соединенија на Галиум, кои во многу аспекти се слични по својства на хемиските соединенија на алуминиум. Покрај тоа, познати се едно- и двовалентни соединенија. Високиот оксид Ga 2 O 3 е бела супстанца, нерастворлива во вода. Соодветниот хидроксид се таложи од растворите на соли на Галиум во форма на бел желатинозен талог. Има изразен амфотеричен карактер. Кога се раствораат во алкали, се формираат галати (на пример, Na), кога се раствораат во киселини, соли на галиум се формираат: Ga 2 (SO 4) 3, GaCl 3, итн. Киселинските својства на галиум хидроксид се поизразени од оние на алуминиум хидроксид [Опсегот на ослободување на Al (OH) 3 лежи во опсегот на pH = 10,6-4,1, а Ga(OH) 3 во опсегот на pH = 9,7-3,4].
За разлика од Al(OH) 3, галиум хидроксид се раствора не само во силни алкали, туку и во раствори на амонијак. Кога ќе се вари, галиум хидроксид повторно се таложи од растворот на амонијак.
Од солите на Галиум, најважни се GaCl 3 хлоридот (се топи 78°C, врие 200°C) и Ga 2 (SO 4) 3 сулфат. Вториот, со сулфати на алкални метали и амониум, формира двојни соли од типот стипса, на пример (NH 4)Ga(SO 4) 2 12H 2 O. Галиумот формира фероцианид Ga 4 3, кој е слабо растворлив во вода и разреден киселини, кои може да се користат за да се одвои од Al и голем број други елементи.
Добивање галиум. Главниот извор за добивање на Галиум е производството на алуминиум. При обработката на бокситот со методот Баер, галиумот се концентрира во циркулирачките мајчини ликери по одвојувањето на Al(OH) 3 . Галиумот се изолира од таквите раствори со електролиза на жива катода. Од алкалниот раствор добиен по обработката на амалгамот со вода, се таложи Ga(OH) 3, кој се раствора во алкали и Галиумот се изолира со електролиза.
Во методот на сода-вар за преработка на боксит или нефелинска руда, галиумот се концентрира во последните фракции на седиментот ослободен за време на процесот на карбонизација. За дополнително збогатување, талогот од хидроксид се третира со варово млеко. Во овој случај, поголемиот дел од Al останува во седиментот, а Галиумот оди во раствор, од кој концентратот на галиум (6-8% Ga 2 O 3) се изолира со пропуштање на CO 2; вториот се раствора во алкали и галиумот се изолира електролитски.
Изворот на Галиум може да биде и преостанатата анодна легура од процесот на рафинирање на Al со помош на методот на електролиза со три слоја. Во производството на цинк, извори на галиум се сублимации (Велц оксиди) кои се формираат при преработка на јаловина од лужење на цинк гареж.
Течниот галиум добиен со електролиза на алкален раствор, измиен со вода и киселини (HCl, HNO 3), содржи 99,9-99,95% Ga. Почист метал се добива со вакуумско топење, зонско топење или со извлекување на еден кристал од топењето.
Примена на Галиум.Најперспективната примена на галиумот е во форма на хемиски соединенија како GaAs, GaP, GaSb, кои имаат полупроводнички својства. Тие можат да се користат во исправувачи и транзистори со висока температура, соларни панели и други уреди каде што може да се користи фотоелектричниот ефект во блокирачкиот слој, како и во приемниците на инфрацрвено зрачење. Галиумот може да се користи за производство на оптички огледала кои се многу рефлектирачки. Предложена е легура на алуминиум со галиум наместо жива како катода на светилки со ултравиолетово зрачење што се користат во медицината. Се предлага да се користи течен галиум и неговите легури за производство на термометри со висока температура (600-1300°C) и мерачи на притисок. Од интерес е употребата на Галиум и неговите легури како течно средство за ладење во енергетските нуклеарни реактори (ова е попречено од активната интеракција на Галиум при работни температури со структурните материјали; еутектичката легура Ga-Zn-Sn има помалку корозивен ефект од чистата Галиум).
Индиум(лат. Индиум), Во, хемиски елемент од групата III од периодичниот систем на Менделеев; атомски број 49, атомска маса 114,82; бел сјаен мек метал. Елементот се состои од мешавина од два изотопи: 113 In (4,33%) и 115 In (95,67%); вториот изотоп има многу слаба β-радиоактивност (полуживот T S = 6·10 14 години).
Во 1863 година, германските научници Ф. Рајх и Т. Рихтер, за време на спектроскопско истражување на мешавината на цинк, откриле нови линии во спектарот кои припаѓаат на непознат елемент. Врз основа на светло сината (индиго) боја на овие линии, новиот елемент го доби името индиум.
Дистрибуција на Индија во природата. Индиумот е типичен микроелемент неговата просечна содржина во литосферата е 1,4·10 -5% по маса. За време на магматските процеси, мала акумулација на индиум се јавува во гранитите и другите кисели карпи. Главните процеси на индиска концентрација во земјината кора се поврзани со топли водени раствори кои формираат хидротермални наслаги. Индиумот во нив е врзан со Zn, Sn, Cd и Pb. Сфалеритите, халкопиритите и каситритите се збогатуваат со Индиум во просек 100 пати (содржина околу l.4·10 -3%). Познати се три минерали на Индија - мајчин Индиум, рокзит CuInS 2 и indite In 2 S 4, но сите од нив се исклучително ретки. Акумулацијата на Индија во сфалерити (до 0,1%, понекогаш 1%) е од практично значење. Збогатувањето на Индија е типично за наоѓалиштата на рудниот појас на Пацификот.
Физички својства Индија.
Кристалната решетка на Индија е тетрагонална, насочена кон лицето, со параметри a = 4,583E и c = 4,936E. Атомски радиус 1,66E; јонски радиуси Во 3+ 0,92E, Во + 1,30E; густина 7,362 g/cm3. Индиумот е топлив, неговата точка на топење е 156,2 °C; точка на вриење 2075 °C. Температурен коефициент на линеарно проширување 33·10 -6 (20 °C); специфичен топлински капацитет на 0-150°C 234,461 J/(kg K), или 0,056 cal/(g °C); електричен отпор на 0°C 8,2·10 -8 ом·м, или 8,2·10 -6 ом·см; модул на еластичност 11 n/m 2, или 1100 kgf/mm 2; Тврдост на Бринел 9 Mn/m2 или 0,9 kgf/mm2.
Хемиски својства Индија.
Во согласност со електронската конфигурација на атомот 4d 10 5s 2 5p 1 Индиумот во соединенијата покажува валентност 1, 2 и 3 (претежно). Во воздухот, во цврста компактна состојба, индиумот е стабилен, но оксидира на високи температури, а над 800 ° C гори со виолетово-син пламен, давајќи In 2 O 3 оксид - жолти кристали, високо растворливи во киселини. Кога се загрева, индиумот лесно се комбинира со халогени, формирајќи растворливи халиди InCl 3, InBr 3, InI 3. Со загревање на Индија во проток на HCl, се добива InCl 2 хлорид, а кога пареата InCl 2 ќе се помине преку загреаниот In, се формира InCl. Со сулфур, индиумот формира сулфиди Во 2 S 3, InS; ги даваат соединенијата InS·In 2 S 3 и 3InS·In 2 S 3. Во вода во присуство на оксидирачки агенси, индиумот полека кородира од површината: 4In + 3O 2 + 6H 2 O = 4In(OH) 3. Индиумот е растворлив во киселини, неговиот нормален електроден потенцијал е -0,34 V и практично нерастворлив во алкалии. Индиските соли лесно се хидролизираат; производ за хидролиза - основни соли или хидроксид In(OH) 3. Вториот е високо растворлив во киселини и слабо растворлив во алкални раствори (со формирање на соли - индати): In(OH) 3 + 3KOH = K 3. Соединенијата на индиум со пониски состојби на оксидација се прилично нестабилни; халиди InHal и црниот оксид In 2 O се многу силни редукциони средства.
Прием Индија.
Индиумот се добива од отпад и меѓупроизводи од производството на цинк, олово и калај. Оваа суровина содржи од илјадити до десетини од процентот Индија. Екстракцијата на Индија се состои од три главни фази: добивање збогатен производ - концентрат од Индија; преработка на концентрат до суров метал; рафинирање. Во повеќето случаи, суровина се третира со сулфурна киселина и индиумот се пренесува во раствор, од кој концентратот се изолира со хидролитичко таложење. Груб индиум се изолира главно со цементирање на цинк или алуминиум. Рафинирањето се врши со хемиски, електрохемиски, дестилации и кристалофизички методи.
Апликација Индија.
Индиумот и неговите соединенија (на пример, InN нитрид, InP фосфид, InSb антимонид) се најшироко користени во технологијата на полупроводници. Индиумот се користи за различни антикорозивни премази (вклучувајќи ги и облогите на лежиштата). Индиумските облоги имаат висока рефлексивност, која се користи за изработка на огледала и рефлектори. Некои легури на индиум се од индустриско значење, вклучувајќи легури со ниска топење, лемови за лепење стакло на метал и други.
Талиум(лат. Талиум), Tl, хемиски елемент од III група на периодичниот систем на Менделеев, атомски број 81, атомска маса 204,37; на свеж рез има сив сјаен метал; се однесува на ретки елементи во трагови. Во природата, елементот е претставен со два стабилни изотопи 203 Tl (29,5%) и 205 Tl (70,5%) и радиоактивни изотопи 207 Tl - 210 Tl - членови на радиоактивната серија. Вештачки се добиени радиоактивните изотопи 202 Tl (T S = 12,5 дена), 204 Tl (T S = 4,26 години), 206 Tl (T S = 4,19 мин) и други. Талиумот е откриен во 1861 година од страна на В. Крукс во тињата од производството на сулфурна киселина со помош на спектроскопски метод по карактеристичната зелена линија во спектарот (оттука и името: од грчкиот талос - млада, зелена гранка). Во 1862 година, францускиот хемичар C. O. Lamy прв го изолирал талиумот и ја утврдил неговата метална природа.
Дистрибуција на талиум во природата. Просечната содржина на талиум во земјината кора (кларк) е 4,5·10 -5% по маса, но поради екстремната дисперзија неговата улога во природните процеси е мала. Во природата, соединенијата на едновалентен и поретко тривалентен талиум се наоѓаат претежно. Како и алкалните метали, талиумот е концентриран во горниот дел од земјината кора - во гранитниот слој (просечна содржина 1,5 10 -4%), во основните карпи е помалку (2 10 -5%), а во ултрабазичните карпи само 1 10 -6%. Познати се само седум минерали на талиум (на пример, круксит, лорандит, врбаит и други), сите од нив се исклучително ретки. Талиумот има најголема геохемиска сличност со K, Rb, Cs, како и со Pb, Ag, Cu, Bi. Талиумот лесно мигрира во биосферата. Од природните води се сорбира со јаглен, глина, манган хидроксид и се акумулира при испарување на водата (на пример, во езерото Сиваш до 5·10 -8 g/l).
Физички својства на талиумот
Талиумот е мек метал кој лесно се оксидира во воздухот и брзо се оцрнува. Талиумот при притисок од 0,1 Mn/m2 (1 kgf/cm2) и температура под 233 °C има шестоаголна затворена решетка (a = 3,4496E; c = 5,5137E), над 233 °C - тело во центарот кубни (a = 4,841E), при високи притисоци 3,9 H / m 2 (39.000 kgf / cm 2) - кубни во центарот на лицето; густина 11,85 g/cm3; атомски радиус 1,71 E, јонски радиус: Tl + 1,49 E, Tl 3+ 1,05 E; Точка на топење 303,6 °C; Точка на вриење 1457 °C, специфичен топлински капацитет 0,130 kJ/(kg K) на 20-100 °C; температурен коефициент на линеарно проширување 28·10 -6 на 20 °C и 41,5·10 -6 на 240-280 °C; топлинска спроводливост 38,94 W/(m -K). Електрична отпорност на 0 °C (18·10 -6 оми -cm); температурен коефициент на електричен отпор 5,177·10 -3 - 3,98·10 -3 (0-100 °C). Температурата на премин во суперспроводлива состојба е 2,39 К. Талиумот е дијамагнетен, неговата специфична магнетна подложност е -0,249·10 -6 (30 °C).
Хемиски својства на талиум.
Конфигурација на надворешната електронска обвивка на атомот Tl 6s 2 6р 1 ; во соединенијата има оксидациона состојба од +1 и +3. Талиумот реагира со кислород и халогени веќе на собна температура, а со сулфур и фосфор кога се загрева. Добро се раствора во азотни киселини, помалку во сулфурни киселини и не се раствора во водородни халиди, мравја, оксална и оцетна киселина. Не комуницира со алкални раствори; свежо дестилирана вода, која не содржи кислород, нема ефект врз талиумот. Главните соединенија со кислород се оксид (I) Tl 2 O и оксид (III) Tl 2 O 3. Талиум (I) оксид и Tl (I) соли (нитрати, сулфат, карбонат) се растворливи; хромат, дихромат, халиди (освен флуор), како и талиум (III) оксид - се малку растворливи во вода. Tl(III) формира голем број сложени соединенија со неоргански и органски лиганди. Tl (III) халидите се многу растворливи во вода. Tl(I) соединенијата се од најголемо практично значење.
Добивање талиум.
Во индустриски размери, техничкиот талиум се добива како нуспроизвод од преработка на сулфидни руди на обоени метали и железо. Се извлекува од полупроизводи од производството на олово, цинк и бакар. Изборот на методот на обработка на суровината зависи од неговиот состав. На пример, за да се извлечат талиум и други вредни компоненти од прашината за производство на олово, материјалот се сулфира во флуидизирано корито на 300-350 °C. Добиената сулфатна маса се исцедува со вода, а талиумот се екстрахира од растворот со 50% раствор на трибутил фосфат во керозин што содржи јод, а потоа повторно се екстрахира со сулфурна киселина (300 g/l) со додавање на 3% водород. пероксид. Металот е изолиран од повторни екстракти со цементирање на цинкови листови. По топење под слој на сода сода, се добива талиум со чистота од 99,99%. За подлабоко прочистување на металот, се користат електролитичко рафинирање и прочистување со кристализација. алуминиум, галиум, индиум
Примена на талиум.
Во технологијата, талиумот се користи главно во форма на соединенија. Еднокристали на цврсти раствори на халиди TlBr - TlI и TlCl - TlBr (познати во технологијата како KRS-5 и KRS-6) се користат за производство на оптички делови во инфрацрвени уреди; TlCl и TlCl-TlBr- кристали како радијатори за черенковски бројачи. Tl 2 O е составен дел на некои оптички очила; сулфиди, оксисулфиди, селениди, телуриди - компоненти на полупроводнички материјали што се користат во производството на фотоотпорници, полупроводнички исправувачи, видикони. Воден раствор од мешавина од мравја и талиум малонат (тешка течност Clerici) е широко користен за одвојување на минералите по густина. Амалгамот на талиум, кој се стврднува на -59°C, се користи во термометри со ниски температури. Металот талиум се користи за производство на лежишта и легури со малку топење, како и во мерачи на кислород за одредување на кислородот во водата. 204 Tl се користи како извор на бета зрачење во уредите со радиоизотоп.
Бор(лат. Борум), Б, хемиски елемент од III група на периодичниот систем на Менделеев, атомски број 5, атомска маса 10,811; Кристалите се сиво-црни (многу чистиот бор е безбоен). Природниот бор се состои од два стабилни изотопи: 10 B (19%) и 11 B (81%).
Претходно познатото соединение на бор - боракс - се споменува во списите на алхемичарите под арапското име „бурак“ и латинскиот Боракс, од каде што доаѓа и името „бор“. Слободниот бор (нечист) првпат бил добиен од француските хемичари J. Gay-Lussac и L. Thénard во 1808 година со загревање на борниот анхидрид B 2 O 3 со калиум метал. Вкупната содржина на бор во земјината кора е 3·10 -4% по маса. Борот не се наоѓа во природата во слободна состојба. Многу соединенија на бор се широко распространети, особено во ниски концентрации. Во форма на боросиликати, борати, бороалумосиликати, а исто така и како изоморфна нечистотија во други минерали, Борот е дел од многу магматски и седиментни карпи. Борните соединенија се наоѓаат во нафтените води, морската вода, солените езера, топлите извори, во вулканската и ридската кал и во многу почви.
Физички својства на бор.
Познати се неколку кристални модификации на борот. Атомите на бор формираат тродимензионална рамка во овие структури, слична на атомите на јаглерод во дијамантот. Ова ја објаснува високата цврстина на Борот. Сепак, структурата на рамката во структурите на Бор е многу посложена отколку во дијамантот. Главната структурна единица во Боровите кристали се дваесет хедри (икоаедрони), на темињата на секоја од кои има 12 атоми на бор. Икозаедроните се поврзани едни со други и директно и преку средните Бор атоми кои не се дел од ниту еден икозаедар. Со оваа структура, излегува дека атомите на бор во кристалите имаат различни координативни броеви: 4, 5, 6 и 5 + 2 (5 блиски „соседи“ и 2 подалечни). Бидејќи надворешната обвивка на атомот на Бор содржи само 3 електрони (електронска конфигурација 2s 2 2p 1), има значително помалку од два електрони за секоја врска присутна во кристалниот Бор. Во согласност со современите концепти, во борните кристали се јавува посебен тип на ковалентна врска - мултицентрична врска со недостаток на електрони. Во јонските соединенија, борот е 3-валентен. Таканаречениот „аморфен“ бор, добиен со редукција на B 2 O 3 со метален натриум или калиум, има густина од 1,73 g/cm 3 . Чистиот кристален бор има густина од 2,3 g/cm 3, точка на топење од 2030°C, точка на вриење од 3860°C; Тврдоста на бор на минералошката скала е 9, микротврдоста е 34 Gn/m2 (3400 kgf/mm2). Кристалниот бор е полупроводник. Во нормални услови, слабо ја спроведува струјата. Кога се загрева до 800°C, електричната спроводливост на Бор се зголемува за неколку реда на големина, а знакот на спроводливост се менува (електронски при ниски температури, дупка на високи температури).
Хемиски својства на бор.
Хемиски, Борот во нормални услови е прилично инертен (активно комуницира само со флуор), а кристалниот бор е помалку активен од аморфниот. Со зголемување на температурата, активноста на борот се зголемува и се комбинира со кислород, сулфур и халогени. Кога се загрева во воздух до 700°C, борот гори со црвеникав пламен, формирајќи борен анхидрид B 2 O 3 - безбојна стаклена маса. Кога се загрева над 900 °C, борот со азот формира бор нитрид BN, кога се загрева со јаглен - бор карбид B 4 C 3, со метали - бориди. Борот не реагира забележливо со водородот; неговите хидриди (борохидриди) се добиваат индиректно. На црвено-жешка температура, борот комуницира со водена пареа: 2B + 3H 2 O = B 2 O 3 + 3H 2. Борот не се раствора во киселини на обични температури, освен концентрирана азотна киселина, која ја оксидира до борна киселина H 3 BO 3. Полека се раствора во концентрирани алкални раствори за да формира борати.
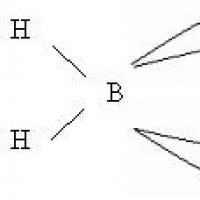
Во BF 3 флуоридот и другите халиди, борот е поврзан со халогените со три ковалентни врски. Бидејќи на атомот на Бор во халидот BX 3 му недостигаат пар електрони за да се комплетира стабилна 8-електронска обвивка, молекулите на халид, особено BF 3, прикачуваат молекули на други супстанции кои имаат слободни електронски парови, како што е амонијак.
Во такви сложени соединенија, атомот на Бор е опкружен со четири атоми (или групи на атоми), што одговара на координативниот број 4 карактеристика на Борот во неговите соединенија Важни сложени соединенија на бор се борохидридите, на пример Na и флуороборните или флуороводоводните. киселина H, формирана од BF3 и HF; Повеќето соли на оваа киселина (флуороборати) се растворливи во вода (со исклучок на солите K, Rb, Cs). Заедничка карактеристика на самиот бор и неговите соединенија е нивната сличност со силициумот и неговите соединенија. Така, борната киселина, како силициумовата киселина, има слаби киселински својства и се раствора во HF за да формира гасовита BF 3 (силициумот дава SiF 4). Борохидридите личат на водородни силикати, а борниот карбид наликува на силициум карбид итн. Интересна е посебната сличност на модификациите на BN нитрид со графит или дијамант. Ова се должи на фактот што атомите B и N заеднички имитираат 2 атоми C во нивната електронска конфигурација (B има 3 валентни електрони, N има 5, два атоми C имаат по 4). Оваа аналогија е типична и за други соединенија кои содржат и бор и азот. Така, боразан BH 3 -NH 3 е сличен на етан CH 3 - CH 3, а боразин BH 2 = NH 2 и наједноставниот боразин BH?NH се слични на етилен CH 2 = CH 2 и ацетилен CH?CH, соодветно. Ако тримеризацијата на ацетилен C 2 H 2 дава бензен C 6 H 6, тогаш сличен процес води од боразин BHNH до боразол B 3 N 3 H 6.
Добивање на бор.
Елементарниот бор се добива од природни суровини во неколку фази. Со разложување на борати со топла вода или сулфурна киселина (во зависност од нивната растворливост) се добива борна киселина, а со дехидрација се добива борен анхидрид. Редукцијата на B 2 O 3 со метален магнезиум дава бор во форма на темно кафеав прав; Се чисти од нечистотии со третман со азотни и флуороводоводни киселини. Многу чист бор, неопходен за производство на полупроводници, се добива од неговите халиди: BCl 3 се редуцира со водород на 1200 ° C или пареите BBr 3 се разложуваат на танталова жица загреана на 1500 ° C. Чист бор се добива и со термичко разложување на борохидридите.
Примена на бор. Борот се додава во мали количини (фракции) на челикот и некои легури за да се подобрат нивните механички својства; Веќе додаток на челик од 0,001-0,003% Бор ја зголемува својата сила (борот обично се внесува во челик во форма на феробор, односно легура на железо со 10-20% бор). Заситеноста на површината на челичните делови со бор (до длабочина од 0,1-0,5 mm) ги подобрува не само механичките својства, туку и отпорноста на челикот од корозија. Поради способноста на изотопот 10 B да апсорбира термички неутрони, се користи за правење контролни шипки за нуклеарни реактори, кои се користат за запирање или забавување на реакцијата на фисија. Борот во форма на гасовита BF 3 се користи во неутронските бројачи. (Кога јадрата од 10 V се во интеракција со неутроните, се формираат наелектризирани 6-честички, кои лесно се регистрираат; бројот на 6-честички е еднаков на бројот на неутрони што влегуваат во бројачот: 10 5 V + 1 0 n = 7 3 Li + 4 2 б). Самиот бор и неговите соединенија - BN нитрид, B 4 C 3 карбид, BP фосфид и други - се користат како диелектрици и полупроводнички материјали. Широко се користат борната киселина и нејзините соли (првенствено боракс), боридите и други. BF 3 е катализатор за некои органски реакции.
Бор во телото
. Борот е еден од хемиските елементи кои се наоѓаат во многу мали количини во ткивата на растенијата и животните (илјадати и десет илјадити проценти од сувата тежина). Борот е неопходен за одржување на нормалниот живот на растенијата. Најважниот симптом на дефицит на бор е смртта на точката на растење на главното стебло, а потоа и на аксиларните пупки. Во исто време, ливчињата и лисјата стануваат кревки, цвеќињата не се појавуваат или плодовите не се формираат; затоа, со недостаток на бор, приносот на семето се намалува. Познати се многу болести поврзани со дефицит на бор, на пример, гниење на срцето на шеќерна репка, црна дамка на трпезно цвекло, заруменување на срцето на рутабага и карфиол, сушење на врвот на лен, жолтица на врвот на луцерка, кафеава дамка на кајсии, суберизација на јаболка. Со недостаток на бор, оксидацијата на шеќерите, аминирањето на производи за метаболизмот на јаглени хидрати и синтезата на клеточните протеини се забавуваат; сепак, ензимите за кои Борот е суштински елемент сè уште се непознати. Со недостаток на бор во растенијата, содржината на аденозин трифосфорна киселина се намалува, а се нарушува и процесот на оксидативна фосфорилација, како резултат на што енергијата ослободена за време на дишењето не може да се користи за синтеза на потребните материи. Доколку има недостаток на Бор во почвата, на неа се додаваат борни ѓубрива. Во биогеохемиските провинции со вишок на бор во почвата (на пример, во северозападен Казахстан), се јавуваат морфолошки промени и растителни болести предизвикани од акумулација на бор - гигантизам, џуџест раст, нарушување на точките на раст и други. На почвите со интензивен соленост на бор, постојат области без вегетација, „ќелави дамки“ - еден од знаците за истражување на наоѓалиштето Бора. Значењето на Борот кај животните сè уште не е разјаснето. Кај луѓето и животните (овци, камили), кога се хранат со растенија со вишок содржина на бор (60-600 mg/kg сува материја или повеќе), метаболизмот е нарушен (особено, активноста на протеолитичките ензими) и ендемична болест на се појавува гастроинтестиналниот тракт - борен ентеритис .
Алуминиум(лат. Алуминиум), Al, хемиски елемент од групата III од периодичниот систем на Менделеев; атомски број 13, атомска маса 26,9815; сребрено-бел лесен метал. Се состои од еден стабилен изотоп 27 Ал.
Историска референца. Името Алуминиум доаѓа од латинскиот. алумен - па уште во 500 п.н.е. д. наречена алуминиумска стипса, која се користела како средство за боење ткаенини и за штавење кожа. Данскиот научник Х.К. Првиот индустриски метод за производство на алуминиум беше предложен во 1854 година од францускиот хемичар A. E. Saint-Clair Deville: методот се состоеше во редукција на двојниот хлорид на алуминиум и натриум Na 3 AlCl 6 со метален натриум. Сличен по боја на сребрената, алуминиумот на почетокот беше многу скап. Од 1855 до 1890 година биле произведени само 200 тони алуминиум. Современиот метод за производство на алуминиум со електролиза на топење на криолит-алумина беше развиен во 1886 година истовремено и независно од C. Hall во САД и P. Heroux во Франција.
Дистрибуција на алуминиум во природата.Во однос на изобилството во природата, алуминиумот е на третото место по кислородот и силиконот и на првото место меѓу металите. Неговата содржина во земјината кора е 8,80% по маса. Алуминиумот не се појавува во слободна форма поради неговата хемиска активност. Познати се неколку стотици алуминиумски минерали, главно алумосиликати. Бокситот, алунитот и нефелинот се од индустриско значење. Нефелинските карпи се посиромашни со алумина од боксит, но нивната сложена употреба произведува важни нуспроизводи: сода, поташа, сулфурна киселина. Во СССР е развиен метод за интегрирана употреба на нефелини. Нефелинските руди во СССР формираат, за разлика од бокситот, многу големи наоѓалишта и создаваат практично неограничени можности за развој на алуминиумската индустрија.
Физички својства на алуминиум.
Алуминиумот комбинира многу вреден сет на својства: мала густина, висока топлинска и електрична спроводливост, висока еластичност и добра отпорност на корозија. Лесно може да се фалсификува, печат, валани, нацрта. Алуминиумот е добро заварен со гас, контакт и други видови на заварување. Алуминиумската решетка е кубна во центарот на лицето со параметар a = 4,0413 E. Својствата на алуминиумот, како и сите метали, зависат затоа од неговата чистота. Својства на алуминиум со висока чистота (99,996%): густина (на 20°C) 2698,9 kg/m 3; t pl 660,24°C; точка на вриење околу 2500 ° C; коефициент на термичка експанзија (од 20° до 100°C) 23,86·10 -6 ; топлинска спроводливост (на 190°C) 343 W/m·K, специфичен топлински капацитет (на 100°С) 931,98 J/kg·K. ; електрична спроводливост во однос на бакар (на 20 °C) 65,5%. Алуминиумот има мала цврстина (јакост на истегнување 50-60 Mn/m2), цврстина (170 Mn/m2 според Бринел) и висока еластичност (до 50%). При ладно валање, јакоста на истегнување на Алуминиумот се зголемува до 115 Mn/m2, цврстината - до 270 Mn/m2, релативното издолжување се намалува на 5% (1 Mn/m2 ~ и 0,1 kgf/mm2). Алуминиумот е високо полиран, елоксиран и има висока рефлексивност блиску до среброто (тој рефлектира до 90% од упадната светлосна енергија). Имајќи висок афинитет за кислород, алуминиумот во воздухот е покриен со тенок, но многу цврст филм од Al 2 O 3 оксид, кој го штити металот од понатамошна оксидација и ги одредува неговите високи антикорозивни својства. Јачината на оксидниот филм и неговиот заштитен ефект значително се намалуваат во присуство на нечистотии од жива, натриум, магнезиум, бакар итн. Алуминиумот е отпорен на атмосферска корозија, морска и свежа вода, практично не комуницира со концентриран или високо разреден азотен киселина, органски киселини, прехранбени производи.
Хемиски својства на алуминиум.
Надворешната електронска обвивка на атомот на алуминиум се состои од 3 електрони и има структура 3s 2 3p 1. Во нормални услови, алуминиумот во соединенијата е 3-валентен, но на високи температури може да биде едновалентен, формирајќи таканаречени подсоединенија. Алуминиумските субхалиди, AlF и AlCl, стабилни само во гасовита состојба, во вакуум или во инертна атмосфера, кога температурата се намалува, се распаѓаат (несразмерно) на чист Al и AlF 3 или AlCl 3 и затоа може да се користат за производство на ултрачист алуминиум . Кога се загрева, ситно мелениот или прашкаст алуминиум силно гори во воздухот. Со согорување на алуминиум во проток на кислород се постигнуваат температури над 3000°C. Својството на алуминиумот активно да комуницира со кислородот се користи за обновување на металите од нивните оксиди (Алуминотермија). На темноцрвена топлина, флуорот енергетски комуницира со алуминиумот, формирајќи AlF3. Хлорот и течниот бром реагираат со алуминиум на собна температура, јод - кога се загрева. На високи температури, алуминиумот се комбинира со азот, јаглерод и сулфур, формирајќи AlN нитрид, Al 4 C 3 карбид и Al 2 S 3 сулфид, соодветно. Алуминиумот не комуницира со водородот; Алуминиум хидрид (AlH 3) X е добиен индиректно. Од голем интерес се двојните хидриди на алуминиум и елементите од групите I и II од периодичниот систем на состав MeH n · n AlH 3, таканаречените алуминиумски хидриди. Алуминиумот лесно се раствора во алкали, ослободувајќи водород и формирајќи алуминати. Повеќето алуминиумски соли се многу растворливи во вода. Растворите на алуминиумските соли покажуваат кисела реакција поради хидролиза.
Добивање на алуминиум.
Во индустријата, алуминиумот се произведува со електролиза на алуминиум Al 2 O 3 растворен во стопен криолит NasAlF 6 на температура од околу 950 ° C. Се користат електролизатори од три главни дизајни: 1) електролизатори со континуирано само-печење аноди и странично снабдување со струја , 2) исто, но со горна струја и 3) електролизери со печени аноди. Електролитната бања е железна обвивка, обложена внатре со топлинско и електрично изолационен материјал - огноотпорни тули и обложена со јаглени плочи и блокови. Работниот волумен се полни со стопен електролит кој се состои од 6-8% алумина и 94-92% криолит (обично со додавање на AlF 3 и околу 5-6% од мешавина од калиум и магнезиум флуориди). Катодата е дното на бањата, анодата е изгорени јаглеродни блокови потопени во електролитот или полнети електроди за самопечење. Кога ќе помине струја, стопениот алуминиум се ослободува на катодата, која се акумулира на огништето, а на анодата - кислород, кој формира CO и CO 2 со јаглеродната анода. Алумина, главниот потрошен материјал, има високи барања за чистота и големина на честички. Присуството во него на оксиди на елементи поелектропозитивни од алуминиумот доведува до контаминација на алуминиумот. Со доволна содржина на алумина, бањата работи нормално со електричен напон од редот од 4-4,5 V. Бањите се поврзани со извор на еднонасочна струја во серија (во серија од 150-160 бањи). Современите електролизери работат на струи до 150 kA. Алуминиумот обично се отстранува од бањите со помош на вакуумска канта. Растопен алуминиум со чистота од 99,7% се истура во калапи. Алуминиум со висока чистота (99,9965%) се добива со електролитичко рафинирање на примарен алуминиум со т.н. трислоен метод, со што се намалува содржината на нечистотии Fe, Si и Cu. Студиите на процесот на електролитичко рафинирање на алуминиум со употреба на органски електролити ја покажаа основната можност за добивање на алуминиум со чистота од 99,999% со релативно мала потрошувачка на енергија, но досега овој метод има ниска продуктивност. За длабоко прочистување на алуминиум, се користи зонско топење или дестилација преку субфлуорид.
За време на електролитичкото производство на алуминиум може да дојде до струен удар, висока температура и штетни гасови. За да се избегнат несреќи, кадите се сигурно изолирани, работниците користат суви чизми и соодветна заштитна облека. Здравата атмосфера се одржува со ефективна вентилација. Со постојано вдишување на прашина од метален алуминиум и неговиот оксид, може да се појави пулмонална алуминоза. Работниците кои се занимаваат со производство на алуминиум често имаат катари на горниот респираторен тракт (ринитис, фарингитис, ларингитис). Максималната дозволена концентрација во воздухот на прашина од метален алуминиум, неговиот оксид и легури е 2 mg/m 3.
Примена на алуминиум.
Комбинацијата на физички, механички и хемиски својства на алуминиумот ја одредува неговата широка употреба во речиси сите области на технологијата, особено во форма на неговите легури со други метали. Во електротехниката, Алуминиумот успешно го заменува бакарот, особено во производството на масивни проводници, на пример, во надземни водови, високонапонски кабли, разводни автобуси, трансформатори (електричната спроводливост на Алуминиумот достигнува 65,5% од електричната спроводливост на бакарот и тој е повеќе од три пати полесен од бакар со пресек што обезбедува иста спроводливост, масата на алуминиумските жици е половина од онаа на бакарот. Ултра-чистиот алуминиум се користи во производството на електрични кондензатори и исправувачи, чие дејство се заснова на способноста на филмот од алуминиум оксид да поминува електрична струја само во една насока. Ултрачист алуминиум, прочистен со зонско топење, се користи за синтеза на полупроводнички соединенија од типот A III B V, кои се користат за производство на полупроводнички уреди. Чистиот алуминиум се користи во производството на различни видови рефлектори за огледала. Алуминиум со висока чистота се користи за заштита на металните површини од атмосферска корозија (облога, алуминиумска боја). Поседувајќи релативно низок пресек со апсорпција на неутрони, алуминиумот се користи како структурен материјал во нуклеарните реактори.
Алуминиумските резервоари со голем капацитет складираат и транспортираат течни гасови (метан, кислород, водород итн.), азотни и оцетни киселини, чиста вода, водород пероксид и масла за јадење. Алуминиумот е широко користен во опрема и апарати за прехранбената индустрија, за пакување на храна (во форма на фолија) и за производство на разни видови производи за домаќинството. Нагло е зголемена потрошувачката на алуминиум за доработка на згради, архитектонски, транспортни и спортски објекти.
Во металургијата, алуминиумот (покрај легурите базирани на него) е еден од најчестите адитиви за легирање во легурите базирани на Cu, Mg, Ti, Ni, Zn и Fe. Алуминиумот се користи и за деоксидација на челикот пред да се истури во калап, како и во процесите на производство на одредени метали со методот на алуминотермија. Врз основа на алуминиум, SAP (синтеруван алуминиумски прав) е создаден со употреба на металургија на прав, која има висока отпорност на топлина на температури над 300°C.
Алуминиумот се користи во производството на експлозиви (амонал, алумотол). Широко се користат разни алуминиумски соединенија.
Производството и потрошувачката на алуминиум континуирано расте, значително надминувајќи ја стапката на раст на производството на челик, бакар, олово и цинк.
Објавено на Allbest.ru
Слични документи
Општи карактеристики на п-елементите од III група, нивните основни физички и хемиски својства. Опис на најчестите елементи: подгрупа бор, алуминиум, галиум. Нивната биолошка улога, примена и распространетост. Причини за ефектот на стаклена градина.
теза, додадена 08.08.2015
Карактеристики на галиумот како не најтоплив од метали, точка на топење. Историјата на откривањето на елементот, неговиот опсег. Обиди да се користи галиум во нуклеарни реактори. Патент за употреба на галиум. Реакција на галиум со сулфурна киселина.
апстракт, додаден на 19.01.2010 година
Подготовка, структура и физичко-хемиски својства на галиум трихалиди. Јонски и молекуларни комплекси со органски и неоргански лиганди. Термохемиски карактеристики на комплексите. Синтеза на комплекс од галиум хлорид со 1,2-бис(4-пиридил)етилен.
работа на курсот, додадена 10/05/2015
Физички својства на елементи од главната подгрупа од III група. Општи карактеристики на алуминиум и бор. Природни неоргански јаглеродни соединенија. Хемиски својства на силициумот. Интеракција на јаглеродот со метали, неметали и вода. Својства на оксидите.
презентација, додадена на 09.04.2017 година
Историја на откривањето на хемиски елементи. Резерви и производство на истражени наоѓалишта на индиум и талиум. Физички и хемиски својства на елементите, нивна подготовка и примена. Опасноста од труење со талиум (сол), употреба на пруско сино како противотров.
презентација, додадена 03/11/2014
Периодичен систем Д.И. Менделеев. Карактеристики на хемискиот елемент алуминиум, неговите хемиски и физички својства. Вредноста на „среброто од глина“ во времето на неговото откривање. Начинот на добивање алуминиум, неговата содржина во земјината кора, најважните минерали.
презентација, додадена на 11.11.2011 година
Потекло, методи на подготовка и физичко-хемиски својства на бизмут - хемиски елемент од групата V на периодичниот систем Д.И. Менделеев. Содржина во земјината кора и во вода, екстракција и производство. Примена во индустријата, машинството и медицината.
работа на курсот, додадена на 01.05.2011 година
Својства на алуминиум: неговото производство, примена и хемиски својства. Видови алкалии во алуминатни раствори. Алуминиумски оксиди и хидроксиди. Корунд како најстабилна форма на алумина. Природни алуминиумски соединенија: боксит, корунд, рубин и сафир.
апстракт, додаден на 27.03.2009 година
Општи карактеристики на алуминиумот како елемент на периодниот систем на хемиски елементи. Физичко-хемиски својства на алуминиум. Хемиски експеримент со исчезнување на алуминиумска лажица. Амфотерични својства на алуминиум хидроксид. Невообичаена репресивна реакција.
лабораториска работа, додадена 06.09.2014 година
Атомски, физички и хемиски својства на елементите од подгрупата на бакар и нивните соединенија. Содржина на елементи од подгрупата на бакар во земјината кора. Употреба на пиро- и хидрометалуршки процеси за добивање бакар. Својства на соединенија на бакар, сребро и злато.
Групата IA (главната подгрупа на првата група) од периодниот систем вклучува метали - литиум Li, натриум Na, калиум К, рубидиум Rb, цезиум Cs и франциум Fr. Традиционално, овие елементи се нарекуваат алкални метали (ALM), бидејќи нивните едноставни супстанции формираат каустични алкалии при интеракција со вода. Последниот познат член на групата на алкални метали (Fr) е радиоактивен елемент и затоа неговите хемиски својства не се добро разбрани: полуживотот на неговиот најдолговечен изотоп 223 Fr е само околу 22 минути.
Електронските формули, како и некои својства на алкалните метали, се претставени во табелата подолу:
| Имотот | Ли | На | ДО | Rb | Cs | о |
| Основно полнење З | 3 | 11 | 19 | 37 | 55 | 87 |
| 2s1 | 3s1 | [Ar]4s1 | 5s1 | [Тој] 6s1 | 7s1 | |
| 0,152 | 0,186 | 0,227 | 0,248 | 0,265 | 0,270 | |
| Јонски радиус r јон *, nm | 0,074 | 0,102 | 0,138 | 0,149 | 0,170 | 0,180 |
| Радиус на хидриран јон, r јон, nm | 0,340 | 0,276 | 0,232 | 0,228 | 0,228 | - |
| Енергија на јонизација, kJ/mol: I 1 I 2 | 520,2 7298 | 495,8 4562 | 418,8 3052 | 403,0 2633 | 375,7 2234 | (380) (2100) |
| Електронегативност | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
Кога се движите по групата IA, се зголемува радиусот на атоми на метал (r met), што, всушност, е карактеристично за сите елементи од сите главни подгрупи. Релативно малото зголемување на радиусот при преминот од K во Rb и понатаму до C се должи на пополнувањето на 3d и 4d поднивоата, соодветно.
Јонските радиуси на алкалните метали се значително помали од металните, што е поврзано со губење на еден валентен електрон. Тие, исто така, природно се зголемуваат од Li + до Cs +. Големините на хидрираните катјони се менуваат во спротивна насока, што е објаснето во рамките на наједноставниот електростатички модел. Најмалиот Li + јон ги привлекува поларните молекули на водата кон себе подобро од катјоните на другите алкални метали, формирајќи ја најгустата хидратантна обвивка. Истражувањата покажаа дека во воден раствор, литиумскиот катјон Li+ е опкружен со 26 молекули на вода, од кои само 4 се во директен контакт со јонот на литиум (првата координативна сфера). Поради оваа причина, многу соли на литиум, на пример, хлорид, перхлорат и сулфат, како и хидроксид, се изолирани од водени раствори во форма на кристални хидрати. LiCl·Н 2 O хлоридот губи вода на температура од 95 °C, LiOH·Н 2 O - на 110 °С, а LiClO 4·Н 2 O - само на температури над 150 °С. Со зголемување на јонскиот радиус на катјонот на алкалните метали, јачината на неговата електростатска интеракција со молекулите на водата слабее, што доведува до намалување на дебелината на хидратациската обвивка и, како последица на тоа, радиусот на хидрираниот јон [M (H2O)n] (каде n = 17, 11, 10, 10 за M + = Na +, K +, Rb +, Cs +, соодветно).
Надворешното енергетско ниво на атом на алкален метал содржи еден единствен електрон, кој е слабо врзан за јадрото, што е потврдено со ниските енергетски вредности на јонизација I 1 . Атомите на алкалните метали лесно се јонизираат за да формираат катјони М +, кои се дел од речиси сите хемиски соединенија на овие елементи. Вредностите I 2 за сите алкални метали се толку високи што во реални услови не се формира јонот M 2+. Електронегативноста на алкалните елементи е мала, нивните соединенија со најмногу електронегативни елементи (хлор, кислород, азот) имаат јонска структура, барем во кристална состојба.
Малиот радиус на јонот Li + и високата густина на полнеж се причина што соединенијата на литиум се слични по својства со оние на соединенијата на магнезиум (дијагонална сличност) и во исто време се разликуваат од соединенијата на другите алкални метали.
Група IIA елементи
Групата IIA од Периодниот систем на елементи вклучува берилиум Be, магнезиум Mg и четири земноалкални метали (ALMs): калциум Ca, стронциум Sr, бариум Ba и радиум Ra, чии оксиди, порано наречени „земји“, формираат алкалии при интеракција со вода. Радиумот е радиоактивен елемент (α-распаѓање, полуживот приближно 1600 години).
Електронската конфигурација и некои својства на елементите од втората група се дадени во табелата подолу.
Во однос на електронската структура на нивните атоми, елементите од втората група се блиску до алкалните метали. Тие имаат конфигурација на благороден гас надополнета со
| Имотот | Биди | Мг | Ca | Ср | Ба | Ра |
| Основно полнење З | 4 | 12 | 20 | 38 | 56 | 88 |
| Електронска конфигурација на заземјена состојба | 2s 2 | 3s 2 | 4s 2 | 5s 2 | 6s 2 | 7-ми 2 |
| Метален радиус r исполнет, nm | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Јонски радиус r јон *, nm | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
| Енергија на јонизација, kJ/mol: | 899,5 1757 14850 | 737,7 1451 7733 | 589,8 1145 4912 | 549,5 1064 4138 | 502,8 965 3619 | 509,3 979 3300 |
| Електронегативност | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,90 |
два s електрони на надворешното ниво. Во исто време, тие се разликуваат од елементите на првата група со повисоки енергии на јонизација, кои се намалуваат во серијата Be-Mg-Ca-Sr-Ba. Овој тренд е нарушен кога се движите од бариум во радиум: зголемувањето на P и I за Ra во споредба со Ba се објаснува со ефектот на инертниот пар 6s 2.
Треба да се напомене дека додека алкалните метали се карактеризираат со значајна разлика помеѓу Јас 1 И Јас 2 за елементи од втората група се забележува сличен скок помеѓу Јас 2 И Јас 3 . Затоа алкалните метали во сложените материи покажуваат само оксидациона состојба +1, а елементите од втората група +2. Присуството на една позитивна оксидациска состојба и неможноста за намалување на јоните на M 2+ во водена средина ги прави сите метали од s-блок многу слични.
Промената на својствата низ групата ги следи општите обрасци испитани користејќи го примерот на алкалните метали. Елементот од вториот период, берилиумот, како и елементот од првата група, литиумот, значително се разликува по своите својства од другите елементи од втората група. Така, јонот Be 2+, поради неговиот исклучително мал јонски радиус (0,027 nm), високата густина на полнеж и големите вредности на енергиите на атомизација и јонизација, е стабилен само во гасната фаза при високи температури. Затоа, хемиската врска во бинарни соединенија на берилиум, дури и со најелектронегативните елементи (кислород, флуор) има висок степен на коваленција. Хемијата на водените раствори на берилиум, исто така, има свои специфики: во првата координативна сфера на берилиум може да има само четири лиганди (2+, (Be(OH) 4]-), што се должи на малиот јонски радиус на метал и отсуство на d-орбитали.
Земноалкалните метали (Ca, Sr, Ba, Ra) формираат едно семејство на елементи, во кои некои својства (енергија на хидратација, растворливост и топлинска стабилност на солите) се менуваат монотоно со зголемување на јонскиот радиус, а многу од нивните соединенија се изоморфни.
Елементи од групата IIIA
Група IIIA елементи: бор B, алуминиум Al, галиум Ga, индиум In и талиум Tl - имаат малку стабилни изотопи, што е типично за атоми со непарни атомски броеви. Електронската конфигурација на надворешното енергетско ниво во основната состојба ns 2 nр 1 се карактеризира со присуство на еден неспарен електрон. Во возбудена состојба, елементите од групата IIIA содржат три неспарени електрони, кои, во хибридизација sp 2, учествуваат во формирањето на три ковалентни врски. Во овој случај, на атомите им останува една неокупирана орбитала. Затоа, многу ковалентни соединенија од елементите од групата IIIA се акцептори на електронски пар (Луисова киселина), т.е. можат да формираат четврта ковалентна врска преку механизмот донор-акцептор, создавајќи што тие ја менуваат геометријата на нивната околина - таа се менува од рамна во тетраедарска (состојба на хибридизација sp 3). Борот има многу различни својства од другите елементи од групата IIIA. Тој е единствениот неметален, хемиски инертен и формира ковалентни врски со флуор, азот, јаглерод итн. Хемијата на борот е поблиску до хемијата на силициумот, и тука се манифестира дијагоналната сличност. Празни d-орбитали се појавуваат во атомите на алуминиум и неговите тешки аналози, а атомскиот радиус се зголемува. Галиумот, индиумот и талиумот се наоѓаат веднаш под металите d-блок во Периодниот систем, па затоа често се нарекуваат посттранзициски елементи. Пополнувањето на d-школка е придружено со последователна компресија на атомите во 3d-редот се покажува дека е толку силно што го неутрализира зголемувањето на радиусот кога се појавува четвртото ниво на енергија. Како резултат на d-компресија, јонските радиуси на алуминиумот и галиумот се блиски, а атомскиот радиус на галиумот е уште помал од оној на алуминиумот.
За талиум, олово, бизмут и полониум, најстабилни соединенија се оние со состојби на оксидација +1, +2, +3, +4, соодветно.
За соединенијата од елементите од групата IIIA, состојбата на оксидација е +3. Во серијата бор-алуминиум-галиум-индиум-талиум, стабилноста на таквите соединенија се намалува, додека стабилноста на соединенијата со состојба на оксидација +1, напротив, се зголемува. Енергијата на врската M-Hal во халидите на вторите се намалува за време на преминот од лесни кон потешки елементи, амфотерните својства на оксидите и хидроксидите се поместуваат кон поголема базичност, а тенденцијата на катјоните за хидролиза (интеракција со вода) слабее.
Хемијата на индиумот и особено на галиумот е генерално многу блиска до хемијата на алуминиумот. Соединенијата на овие метали во пониски оксидациски состојби (Ga 2 O, Ga 2 S, InCl, итн.) се непропорционални во водените раствори. За талиумот, состојбата +1, напротив, е најстабилна поради инертноста на електронскиот пар 6s 2.
Алуминиум /> - главен претставник на металите од главната подгрупа III групи од Периодниот систем. Својствата на неговите аналози - галиум, индиум и талиум - наликуваат на оние на алуминиумот, бидејќи сите овие елементи имаат исти електронски конфигурација на надворешен слој ns 2 n стр 1 и може да покаже дипломаоксидација +3.
Електронска структура на елементи од главната подгрупа Група III
|
На. број |
Име и симбол |
Електронска конфигурација |
Атомски радиус, nm. |
PI, eV |
ЕО според Полинг |
Состојби на оксидација |
|
Бор В |
[Не] 2 s 2 2р 1 |
0 , 083 |
||||
|
Алуминиум A l |
3 s 2 Zr 1 |
0 , 143 |
6 , 0 |
1 , 5 |
||
|
Галиум Г а |
[A r] 3 d 10 4 s 2 4р 1 |
0 , 122 |
1 , +3 |
|||
|
Индиум во |
[K r] 4 d 10 5 s 2 5р 1 |
0 , 163 |
5 , 8 |
1 , 7 |
1 , +3 |
|
|
Талиум Т l |
[Тој] 4 f 1 4 5d 10 6s 2 6р 1 |
0 , 170 |
6 , 1 |
1 , +3 |
Како што се зголемува атомската маса, металниот карактер на елементите се зголемува. Борот е неметал, останатите елементи (подгрупа на алуминиум) се метали. Борот значително се разликува по својствата од другите елементи и повеќе како јаглерод исиликон. Останатите елементи се топливи метали,Во и Т л - исклучително мек.
Физички својства на елементите од главната подгрупа Група III
|
Елемент |
Комуникациска енергија, еВ |
ρ, g/cm 3 |
tpl, °C |
t kip, °C |
|
5,83 |
2 , 34 |
2300 |
3658 |
|
|
А л |
3 , 38 |
2 , 70 |
2467 |
|
|
Г а |
2,87 |
5,91 |
29,8 |
2227 |
|
2 , 52 |
7 , 30 |
2080 |
||
|
Т л |
1,89 |
11,85 |
1457 |
Сите елементи на групата се тривалентни, но со зголемување на атомскиот број валентноста станува покарактеристична 1 (Т л претежно едновалентни).
Во серијата В-А l - G а- Во -Т l се намалува киселоста и се зголемува базичноста на хидроксидитеР (OH) 3 . H 3 VO 3 - киселина, А l(OH)3 и G a(OH) 3 - амфотерични основи,Во (OH) 3 и T l (OH) 3 - типични основи. ТлОN е силна основа.
Следно, ќе ги разгледаме својствата на само два елементи: детално - алуминиум, како типичен претставник на п-метали, исклучително широко користен во пракса, и шематски - бор, како претставник на „полуметали“ и покажува аномални својства. во споредба со сите други елементи од подгрупата.
Алуминиумот е најчестиот метал на Земјата (трето место меѓу сите елементи; 8% од составот на земјината кора). Во природата не се јавува како слободен метал; е дел од алумина (Al 2 O 3), боксит (A l 2 O 3 x H 2 O). Покрај тоа, алуминиумот се наоѓа како силикати во карпите како глина, мика и фелдспат.
Алуминиумот има еден стабилен изотоп, борот има два: 19,9% и 80,1%.
Физички својства.Алуминиумот во својата слободна форма е сребрено-бел метал со висока топлинска и електрична спроводливост. Алуминиумот има мала густина - околу три пати помала од онаа на железо или бакар, а во исто време е издржлив метал./>
Борот постои во неколку алотропни модификации. Аморфниот бор е темно кафеав прав. Кристалниот бор е сиво-црн, со метален сјај. Во однос на тврдоста, кристалниот бор е на второ место (по дијамант) меѓу сите супстанции. На собна температура, борот е лош спроводник на електрична енергија; исто како силиконот, има полупроводнички својства.
Хемиски својства.Површината на алуминиум обично е покриена со издржлив филм од оксид Ал 2 О 3, што го штити од интеракција со околината. Ако овој филм се отстрани, металот може енергично да реагира со вода:
2A l + 6H 2 O = 2A l (OH) 3 + ZN 2.
Во форма на струготини или прав, светло гори во воздухот, ослободувајќи голема количина топлина:
2A l + 3/2 O 2 = A l 2 O 3 + 1676 kJ.
Оваа околност се користи за добивање на одреден број метали од нивните оксиди со алуминотермија. Така се нарекува редукцијата со алуминиум во прав на оние метали чија топлина на формирање на оксиди е помала од топлината на формирањето А. l 2 O 3, на пример:
C r 2 O 3 + 2A l = 2C r + A l 2 O 3 + 539 kJ.
Бор, за разлика од алуминиумот, тој е хемиски инертен (особено кристален). Така, тој реагира со кислород само на многу високи температури (> 700°C) со формирање на борен анхидрид B 2 O 3:
2B + ZO 2 = 2B 2 O 3,
Борот не реагира со водапод никакви околности. На уште повисока температура (> 1200°C) реагира со азот, давајќи бор нитрид (кој се користи за производство на огноотпорни материјали):
2B + N 2 = 2BN.
Борот реагира само со флуор на собна температура, додека реакциите со хлор и бром се случуваат само со силно загревање (400 и 600 °C, соодветно); во сите овие случаи формира трихалиди БХал 3 - испарливи течности кои испаруваат во воздухот и лесно се хидролизираат со вода:
2V + 3Вклучено l 2 = 2V на l 3.
Како резултат на хидролиза, се формира ортоборна (борна) киселина H3BO3:
VNA l 3 + 3H 2 O = H 3 VO 3 + ZNNaл.
За разлика од борот, алуминиумот веќе на собна температура активно реагира со сите халогени, формирајќи халиди. Кога се загрева, тој реагира со сулфур (200 °C), азот (800 °C), фосфор (500 °C) и јаглерод (2000 °C):
2A l + 3 S = A l 2 S 3 (алуминиум сулфид),
2A l + N 2 = 2A lN(алуминиум нитрид),
A l + P = A l P (алуминиум фосфид),
4A l + 3C = A l 4 C 3 (алуминиум карбид).
Сите овие соединенија се целосно хидролизирани за да формираат алуминиум хидроксид и, соодветно, водород сулфид, амонијак, фосфин и метан.
Алуминиумот лесно се раствора во хлороводородна киселина од која било концентрација:
2A l + 6NS l = 2A l C l 3 + ZN 2.
Концентрираните сулфурни и азотни киселини немаат ефект врз алуминиумот на студ. Кога се загрева, алуминиумот може да ги намали овие киселини без да ослободува водород:
2A l + 6H 2 S O 4 (конц) = A l 2 (S O 4) 3 + 3 S O 2 + 6H 2 O,
A l + 6H NO 3 (конц) = A l (NO 3 ) 3 + 3 NO 2 + 3H 2 O.
Алуминиумот се раствора во разредена сулфурна киселина, ослободувајќи водород:
2A l + 3H 2 S O 4 = A l 2 (S O 4) 3 + 3H 2.
Во разредена азотна киселина, реакцијата продолжува со ослободување на азотен оксид ( II):
A l + 4 HN O 3 = A l (N O 3) 3 + N O + 2H 2 O.
Алуминиумот се раствора во раствори на алкалии и карбонати на алкални метали за да се формира тетрахидроксиалуминати:
2A l + 2NaOH + 6H 2 O = 2 Na [A l (OH) 4 ] + 3H 2.
Киселините кои не се оксидирачки агенси не реагираат со бор и само концентрирани HNO3 го оксидира до борна киселина:
B + HNO 3 (конц) + H 2 O = H 3 B O 3 + N O