Aldehitler neden oksidasyon reaksiyonlarıyla karakterize edilir? Aldehitlerin oksidasyonu: süreç, son ürün. Aldehit ve ketonların hazırlanması
1. R. Oksidasyon.
Aldehitler kolayca karboksilik asitlere oksitlenir. Oksitleyici maddeler bakır(II) hidroksit, oksit olabilirgümüş, hava oksijeni:
Aromatik aldehitlerin oksitlenmesi alifatik olanlara göre daha zordur. Yukarıda belirtildiği gibi ketonların oksitlenmesi aldehitlere göre daha zordur. Ketonların oksidasyonu, güçlü oksitleyici maddelerin varlığında zorlu koşullar altında gerçekleştirilir. Karboksilik asitlerin karışımı sonucu oluşur. Aldehitleri ketonlardan nasıl ayırt edebilirim? Oksidasyon yeteneğindeki farklılık, aldehitleri ketonlardan ayıran niteliksel reaksiyonların temelini oluşturur. Pek çok hafif oksitleyici madde aldehitlerle kolayca reaksiyona girer ancak ketonlara karşı etkisizdir. a) Kompleks iyonlar + içeren Tollens reaktifi (gümüş oksitin amonyak çözeltisi), aldehitlerle “gümüş ayna” reaksiyonu verir. Bu metalik gümüş üretir. Gümüş oksit çözeltisi hazırlanır dostum dolaylı olarak deneyim:
Tollens reaktifi, aldehitleri, amonyak varlığında amonyum tuzları oluşturan karşılık gelen karboksilik asitlere oksitler. Bu reaksiyonda oksitleyici maddenin kendisi metalik gümüşe indirgenir. Bu reaksiyon sırasında test tüpünün duvarlarında oluşan ince gümüş kaplama nedeniyle aldehitlerin gümüş oksitin amonyak çözeltisi ile reaksiyonuna "gümüş ayna" reaksiyonu adı verilir. CH3-CH=O)+2OH->CH3COONH4+2Ag+3NH3+H2O. Aldehitler ayrıca taze hazırlanmış açık mavi amonyak bakır(II) hidroksit çözeltisini (Fehling reaktifi) sarı bakır(I) hidroksite indirger; bu, ısıtıldığında parlak kırmızı bir bakır(I) oksit çökeltisi açığa çıkarmak üzere ayrışır. CH3-CH=O + 2Cu(OH)2 - CH3COOH+2CuOH+H2O 2CuOH->Cu2O+H2O
2. R. Katılımlar
Hidrojenasyon, hidrojen eklenmesidir.
Karbonil bileşikleri hidrojen, lityum alüminyum hidrit ve sodyum borohidrit ile alkollere indirgenir. Hidrojen C=O bağı yoluyla eklenir. Reaksiyon alkenlerin hidrojenasyonundan daha zordur: ısı, yüksek basınç ve bir metal katalizör (Pt, Ni) gereklidir:
3. Su ile etkileşim Ah.
4. Alkollerle etkileşim.
Aldehitler alkollerle reaksiyona girdiğinde hemiasetaller ve asetaller oluşturulabilir. Hemiasetaller, bir karbon atomunda bir hidroksil ve bir alkoksi grubu içeren bileşiklerdir. Asetaller, molekülleri iki alkoksi ikame edicisine sahip bir karbon atomu içeren maddeleri içerir.
Asetaller aldehitlerden farklı olarak oksidasyona karşı daha dayanıklıdır. Alkollerle etkileşimin tersine çevrilebilirliği nedeniyle, aldehit grubunu "korumak" için organik sentezlerde sıklıkla kullanılırlar.
4.Hidrosülfitlerin eklenmesi.
Hidrosülfit NaHSO3 ayrıca karbonil bileşiğinin yeniden oluşturulabileceği kristalli bir türevi oluşturmak için C=O bağına eklenir. Bisülfit türevleri aldehit ve ketonların saflaştırılmasında kullanılır.
Katalizörlerin varlığında fenolün formaldehit ile polikondensasyonu sonucunda, plastiklerin - fenol plastiklerin (bakalitler) üretildiği fenol-formaldehit reçineleri oluşur. Fenolik plastikler birçok endüstride demir dışı ve demirli metallerin en önemli ikameleridir. Çok sayıda tüketici ürünü, elektrik yalıtım malzemesi ve inşaat parçalarının yapımında kullanılırlar. Fenol-formaldehit reçinesinin bir parçası aşağıda gösterilmiştir:
Aldehit ve keton üretimi için başlangıç bileşikleri hidrokarbonlar, halojen türevleri, alkoller ve asitler olabilir.
Karbonil bileşiklerinin uygulanması
Formaldehit bakalit, deri tabaklama, dezenfeksiyon ve tohum kaplama gibi plastiklerin üretiminde kullanılır. Son zamanlarda ülkemizde kimyasal ve termal stabilitesi yüksek olan poliformaldehit (-CH2-O-)n üretimine yönelik bir yöntem geliştirilmiştir.
Bu, çoğu durumda metallerin yerini alabilen en değerli yapısal plastiktir. Asetaldehit asetik asit ve bazı plastiklerin üretiminde kullanılır. Aseton, birçok bileşiğin (örneğin, polimerizasyonu pleksiglas üreten metil metakrilat) sentezi için bir başlangıç malzemesi olarak kullanılır; aynı zamanda çözücü olarak da kullanılır.
Organik bir maddenin kimyasal formülünü belirlemek için küçük bir kütlesi yakılır ve ardından yanma ürünleri incelenir. Örneğin yanarken 3,75 gram formaldehit aldı 2,25 gram su buharı ve 5,5 gram karbon monoksit (IV). Formaldehitin buhar yoğunluğunun hidrojen cinsinden olduğu bulundu. 15 . Bu verileri kullanarak, içinde kaç gram karbon ve hidrojen bulunduğunu bulun. 3,75 gram formaldehit:
M(C02) = 12 + 32 = 44; M = 44 g/mol
44 g CO2 12 g içerir
5,5 g CO 2" x 1
44 ÷ 5,5 = 12 ÷ x 1; x 1 = (5,5 12) / 44 = 1,5; m(C) = 1,5 g
M(H20) = 2 + 16 = 18; M = 18 g/mol
18 g H 2 O 2 g içerir
2,25 g H20" x 2
18 ÷ 2,25 = 2 ÷ x 2; x 2 = (2,25 2) / 18 = 0,25; m(H) = 0,25 g
Karbon ve hidrojenin toplam kütlesini bulun:
X 1 + x 2 = 1,5 + 0,25 = 1,75
Yanma için 3,75 g formaldehit alındığından oksijenin kütlesi hesaplanabilir:
3,75 - 1,75 = 2; m(O) = 2 g
En basit formülü belirleyin:
C: H: Ö = (1,5 ÷ 12) : (0,25 ÷ 1) : (2 ÷ 16) = 0,125: 0,25: 0,125 = 1: 2: 1
Bu nedenle, incelenen maddenin en basit formülü CH2O.
Formaldehitin hidrojen buharı yoğunluğunu bilerek molar kütlesini hesaplayın:
M = 2D (H2) = 2 15 = 30; M = 30 g/mol
En basit formülü kullanarak molar kütleyi bulun:
M(CH20) = 12 + 2 + 16 = 30; M(CH2O) = 30 g/mol
Bu nedenle formaldehitin moleküler formülü şu şekildedir: CH2O
Formaldehit molekülünde karbon ve hidrojen atomları arasında bir σ bağı, karbon ve oksijen atomları arasında bir σ ve bir π bağı bulunur.
İzomerizm ve isimlendirme
Aldehitler, hidrokarbon radikalinin izomerizmi ile karakterize edilir. Düz veya dallanmış bir zincire sahip olabilir. Aldehitlerin isimleri, oksidasyon sırasında dönüştükleri ilgili organik asitlerin (formaldehit, asetaldehit, propiyonaldehit vb.) tarihsel isimlerinden gelir. Uluslararası terminolojiye göre aldehitlerin isimleri, karşılık gelen hidrokarbonların isimlerinden bir sonek eklenerek türetilir. -al.
Aldehitlerin en önemli temsilcileri.
Metanal veya formaldehit*
Etanal veya asetaldehit*
propanal
Bütanal
2-Metilpropanal
Beşli
Hekzanal

Fiş
İÇİNDE laboratuvarlar aldehitler birincil alkollerin oksidasyonu ile elde edilir. Oksitleyici maddeler olarak kullanılır bakır(II) oksit, hidrojen peroksit ve oksijeni serbest bırakabilen diğer maddeler. Genel olarak şu şekilde gösterilebilir: 
İÇİNDE endüstri aldehitler çeşitli şekillerde hazırlanır. Ekonomik açıdan en karlı olanıdır metanalözel bir reaktörde metanın atmosferik oksijenle doğrudan oksidasyonu.
Metanalın oksitlenmesini önlemek için reaksiyon bölgesinden yüksek hızda metan ve hava karışımı geçirilir.
Metanal ayrıca metanolün oksitlenmesi, buharının havayla birlikte sıcak bakır veya gümüş ağlı bir reaktörden geçirilmesiyle de elde edilir. Ancak bu yöntem ekonomik açıdan daha az karlıdır.
Etanal asetilenin katalizör olarak cıva tuzlarının varlığında hidrasyonuyla da elde edilebilir ( M. G. Kucherov'un tepkisi). Bu reaksiyonda katalizör olarak toksik maddeler - cıva tuzları - kullanıldığından, yakın zamanda asetaldehit üretmek için yeni bir yöntem geliştirildi: etilenin hava ile karışımı, sulu bir bakır, demir ve paladyum tuzları çözeltisinden geçirilir.
Fiziki ozellikleri
Metanal- keskin kokulu, renksiz gaz. Sudaki (% 35 - 40) metanal çözeltisine formalin denir. Aldehit serisinin geri kalan üyeleri sıvı, yüksek olanları ise katıdır.
Kimyasal özellikler
Aldehitler için en tipik reaksiyonlar şunlardır: Oksidasyon ve ekleme.
1. Oksidasyon reaksiyonları
A) Aldehitlere kalitatif reaksiyon reaksiyondur "Gümüş ayna". Bunu gerçekleştirmek için temiz bir test tüpüne dökün gümüş (I) oksidin amonyak çözeltisi(Ag20 pratik olarak suda çözünmez, ancak amonyakla çözünür bir OH bileşiği oluşturur), buna bir aldehit çözeltisi eklenir ve ısıtılır.
İndirgenmiş gümüş, test tüpünün duvarlarına parlak bir kaplama şeklinde yerleşir ve aldehit, karşılık gelen organik asit halinde oksitlenir.
B) Bir diğer karakteristik reaksiyon ise aldehitlerin oksidasyonudur. bakır(II) hidroksit. Mavi bakır (II) hidroksit çökeltisine bir aldehit çözeltisi eklenirse ve karışım ısıtılırsa, önce sarı bir bakır (I) hidroksit çökeltisi belirir ve daha fazla ısıtıldığında bu çökeltiye dönüşür. kırmızı bakır(I) oksit. Bu reaksiyonda oksitleyici madde oksidasyon numarasına sahip bakırdır. +2
oksidasyon durumuna indirgenmiş +1
.
2. İlave reaksiyonları
İlave reaksiyonları karbonil grubunun varlığından kaynaklanır. π bağları, kolayca kırılır. Kopma yerine atomlar ve atom grupları eklenir. Örneğin, bir metanal ve hidrojen karışımı ısıtılmış bir katalizörden geçirildiğinde metanole indirgenir.
Hidrojen ve diğer aldehitler de benzer şekilde eklenir.
TANIM
Aldehitler– karbonil adı verilen –CH = O fonksiyonel grubunu içeren karbonil bileşikleri sınıfına ait organik maddeler.
Doymuş aldehitler ve ketonların genel formülü CnH2nO'dur. Aldehitlerin isimleri –al ekini içerir.
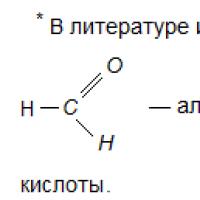
Aldehitlerin en basit temsilcileri formaldehit (formaldehit) -CH2 = O, asetaldehit (asetik aldehit) - CH3 -CH = O'dur. Siklik aldehitler vardır, örneğin sikloheksan-karbaldehit; aromatik aldehitlerin önemsiz isimleri vardır - benzaldehit, vanilin.
Karbonil grubundaki karbon atomu sp2 hibridizasyonu halindedir ve 3σ bağı (iki C-H bağı ve bir C-O bağı) oluşturur. π bağı karbon ve oksijen atomlarının p elektronları tarafından oluşturulur. C=O çift bağı σ ve π bağlarının birleşimidir. Elektron yoğunluğu oksijen atomuna doğru kayar.
Aldehitler, karbon iskeletinin izomerizminin yanı sıra ketonlarla sınıflar arası izomerizm ile karakterize edilir:
CH3-CH2-CH2-CH = O (butanal);
CH3-CH(CH3)-CH = O(2-metilpentanal);
CH3-C (CH2-CH3) = O (metil etil keton).
Aldehitlerin kimyasal özellikleri
Aldehit moleküllerinin birkaç reaksiyon merkezi vardır: nükleofilik katılma reaksiyonlarına katılan bir elektrofilik merkez (karbonil karbon atomu); ana merkez, yalnız elektron çiftlerine sahip bir oksijen atomudur; yoğunlaşma reaksiyonlarından sorumlu a-CH asit merkezi; Oksidasyon reaksiyonlarında kırılan bir C-H bağı.
1. İlave reaksiyonları:
- heme-diol oluşumu ile su
R-CH = O + H20 ↔ R-CH(OH)-OH;
- hemiasetal oluşumuna sahip alkoller
CH3-CH = O + C2H5OH ↔CH3-CH(OH)-0-C2H5;
— ditiyoasetallerin oluşumu ile tiyoller (asidik bir ortamda)
CH3-CH = O + C2H5SH ↔ CH3-CH(SC2H5) -SC2H5 + H20;
— sodyum a-hidroksisülfonatların oluşumuyla birlikte sodyum hidrosülfit
C2H5-CH = O + NaHSO3 ↔ C2H5-CH(OH)-S03Na;
- N-ikame edilmiş iminlerin (Schiff bazları) oluşumu ile aminler
C 6 H 5 CH = O + H 2 NC 6 H 5 ↔ C 6 H 5 CH = NC 6 H 5 + H 2 O;
- Hidrazonlar oluşturmak için hidrazinler
CH3-CH = O + 2 HN-NH2 ↔ CH3-CH = N-NH2 + H20;
- nitril oluşumu ile hidrosiyanik asit
CH3-CH = O + HCN ↔ CH3-CH(N)-OH;
- iyileşmek. Aldehitler hidrojenle reaksiyona girdiğinde birincil alkoller elde edilir:
R-CH = O + H2 → R-CH2-OH;
2. Oksidasyon
- “gümüş ayna” reaksiyonu - aldehitlerin gümüş oksit amonyak çözeltisi ile oksidasyonu
R-CH = O + Ag20 → R-CO-OH + 2Ag↓;
- aldehitlerin bakır (II) hidroksit ile oksidasyonu, bunun sonucunda kırmızı bir bakır (I) oksit çökeltisi oluşur.
CH3-CH = O + 2Cu(OH)2 → CH3-COOH + Cu20↓ + 2H20;
Bu reaksiyonlar aldehitlere verilen kalitatif reaksiyonlardır.
Aldehitlerin fiziksel özellikleri
Homolog aldehit serisinin ilk temsilcisi formaldehittir (formaldehit) - gaz halinde bir madde (n.s.), dallanmamış yapıdaki aldehitler ve C2-C12 - sıvılar, C13 ve daha uzun - katılar. Düz bir aldehit ne kadar çok karbon atomu içerirse kaynama noktası da o kadar yüksek olur. Aldehitlerin moleküler ağırlığındaki artışla birlikte viskozite, yoğunluk ve kırılma indeksi değerleri de artar. Formaldehit ve asetaldehit suyla sınırsız miktarda karışabilir ancak hidrokarbon zincirinin büyümesiyle aldehitlerin bu yeteneği azalır. Düşük aldehitlerin keskin bir kokusu vardır.
Aldehitlerin hazırlanması
Aldehit elde etmenin ana yöntemleri:
- alkenlerin hidroformilasyonu. Bu reaksiyon, bazı Grup VIII metallerinin karbonillerinin, örneğin oktakarbonil dikobaltın (Co2(CO)8) varlığında bir alkene CO ve hidrojenin eklenmesinden oluşur. Reaksiyon, 130°C'ye ısıtılarak gerçekleştirilir. 300 atm basınç
CH3-CH = CH2 + CO +H2 →CH3-CH2-CH2-CH = O + (CH3)2CHCH = O;
- alkinlerin hidrasyonu. Alkinlerin su ile etkileşimi cıva (II) tuzlarının varlığında ve asidik bir ortamda meydana gelir:
HC≡CH + H20 → CH3-CH = O;
- birincil alkollerin oksidasyonu (reaksiyon ısıtıldığında meydana gelir)
CH3-CH2-OH + CuO → CH3-CH = O + Cu + H20.
Aldehitlerin uygulanması
Aldehitler çeşitli ürünlerin sentezinde hammadde olarak yaygın şekilde kullanılmaktadır. Böylece formaldehitten (büyük ölçekli üretim) çeşitli reçineler (fenol-formaldehit vb.) ve ilaçlar (ürotropin) elde edilir; asetaldehit, asetik asit, etanol, çeşitli piridin türevleri vb. sentezi için bir hammaddedir. Parfümeride bileşen olarak birçok aldehit (bütirik, tarçın vb.) kullanılır.
Problem çözme örnekleri
ÖRNEK 1
| Egzersiz yapmak | CnH2n+2'nin brominasyonuyla 9,5 g monobromür elde ettik; bu, seyreltik bir NaOH çözeltisi ile işlendiğinde oksijen içeren bir bileşiğe dönüştü. Havayla birlikte buharları sıcak bakır ağ üzerinden geçirilir. Ortaya çıkan yeni gaz halindeki madde, fazla miktarda Ag20 amonyak çözeltisi ile işlendiğinde 43,2 g çökelti açığa çıktı. Hangi hidrokarbon ve hangi miktarda alınmışsa, bromlama aşamasında verim %50 ise geri kalan reaksiyonlar niceliksel olarak ilerler. |
| Çözüm | Meydana gelen tüm reaksiyonların denklemlerini yazalım: CnH2n+2 + Br2 = CnH2n+1 Br + HBr; CnH2n+1 Br + NaOH = CnH2n+1OH + NaBr; CnH2n+1OH → R-CH = O; R-CH = O + Ag20 → R-CO-OH + 2Ag↓. Son reaksiyonda açığa çıkan çökelti gümüştür, dolayısıyla açığa çıkan gümüş maddesinin miktarını bulabilirsiniz: M(Ag) = 108 g/mol; v(Ag) = m/M = 43,2/108 = 0,4 mol. Sorunun koşullarına göre, reaksiyon 2'de elde edilen maddenin sıcak metal bir ağ üzerinden geçirilmesinden sonra bir gaz oluştu ve tek gaz - aldehit - metanaldır, dolayısıyla başlangıç maddesi metandır. CH4 + Br2 = CH3Br + HBr. Bromometan maddesi miktarı: v(CH3Br) = m/M = 9,5/95 = 0,1 mol. O halde %50 bromometan verimi için gereken metan maddesi miktarı 0,2 mol'dür. M(CH4) = 16 g/mol. Bu nedenle metanın kütlesi ve hacmi: m(CH4) = 0,2×16 = 3,2 g; V(CH4) = 0,2 × 22,4 = 4,48 l. |
| Cevap | Metan kütlesi - ağırlık 3,2 g, metan hacmi - 4,48 l |
ÖRNEK 2
| Egzersiz yapmak | Aşağıdaki dönüşümleri gerçekleştirmek için kullanılabilecek reaksiyon denklemlerini yazın: büten-1 → 1-bromobütan + NaOH → A – H 2 → B + OH → C + HCl → D. |
| Çözüm | Büten-1'den 1-bromobutan elde etmek için, peroksit bileşikleri R202 varlığında bir hidrobrominasyon reaksiyonunun gerçekleştirilmesi gerekir (reaksiyon Markovnikov kuralına aykırı olarak ilerler): CH3-CH2-CH = CH2 + HBr → CH3-CH2-CH2-CH2Br. Sulu bir alkali çözeltisi ile etkileşime girdiğinde 1-bromobutan, bütanol-1 (A) oluşturmak üzere hidrolize uğrar: CH3-CH2-CH2-CH2Br + NaOH → CH3-CH2-CH2-CH2OH + NaBr. Butanol-1, hidrojeni giderildiğinde bir aldehit - butanal (B) oluşturur: CH3-CH2-CH2-CH2OH → CH3-CH2-CH2-CH = O. Gümüş oksitten oluşan bir amonyak çözeltisi, bütanal'i amonyum tuzuna - amonyum bütirata (C) oksitler: CH3-CH2-CH2-CH = O + OH →CH3-CH2-CH2-COONH4 + 3NH3 + 2Ag↓ +H20. Amonyum bütirat hidroklorik asitle reaksiyona girerek bütirik asit (D) oluşturur: CH3-CH2-CH2-COONH4 + HC1 → CH3-CH2-CH2-COOH + NH4Cl. |
Oksijen içeren organik bileşikler arasında, yapı ve özellik benzerlikleri açısından her zaman birlikte incelenen iki sınıf madde büyük önem taşımaktadır. Bunlar aldehitler ve ketonlardır. Pek çok kimyasal sentezin temelini oluşturan da bu moleküllerdir ve yapıları araştırmaya konu olacak kadar ilgi çekicidir. Bu bileşik sınıflarının neler olduğuna daha yakından bakalım.
Aldehitler ve ketonlar: genel özellikler
Kimyasal açıdan bakıldığında, aldehit sınıfı, karbonil adı verilen -SON fonksiyonel grubunun bir parçası olarak oksijen içeren organik molekülleri içermelidir. Bu durumda genel formül şu şekilde görünecektir: R-COH. Doğaları gereği bunlar hem sınırlayıcı hem de sınırlayıcı olmayan bileşikler olabilir. Ayrıca aralarında alifatik olanların yanı sıra aromatik temsilciler de var. Radikal zincirdeki karbon atomlarının sayısı, bir taneden (formaldehit veya metanal) birkaç düzineye kadar oldukça geniş bir aralıkta değişir.
Ketonlar ayrıca bir karbonil grubu -CO içerir, ancak bu bir hidrojen katyonuna değil, zincirdekinden farklı veya aynı olan başka bir radikale bağlanır. Genel formül şuna benzer: R-CO-R, . Bu bileşimdeki fonksiyonel bir grubun varlığında aldehitlerin ve ketonların benzer olduğu açıktır.
Ketonlar ayrıca doymuş ve doymamış olabilir ve sergilenen özellikler yakından ilişkili bir sınıfın özelliklerine benzer. Moleküllerin bileşimini göstermek ve söz konusu maddelerin formülleri için kabul edilen tanımları yansıtmak için çeşitli örnekler verilebilir.
- Aldehitler: metanal - HCOH, bütanal - CH3-CH2-CH2-CH, fenilasetik - C6H5-CH2-CH.
- Ketonlar: aseton veya dimetil keton - CH3-CO-CH3, metil etil keton - CH3-CO-C2H5 ve diğerleri.
Açıkçası, bu bileşiklerin adı iki şekilde oluşturulmuştur:
- bileşimde yer alan radikallere ve -al (aldehitler için) ve -on (ketonlar için) sınıf ekine göre rasyonel isimlendirmeye göre;
- önemsiz, tarihsel olarak kurulmuş.
Her iki madde sınıfı için genel formülü verirsek, bunların birbirlerinin izomerleri olduğu anlaşılacaktır: C n H 2n O. Kendileri aşağıdaki izomerizm türleri ile karakterize edilir:

Her iki sınıfın temsilcileri arasında ayrım yapmak için çoğu aldehitin tanımlanmasına izin veren niteliksel reaksiyonlar kullanılır. Bu maddelerin kimyasal aktivitesi, bir hidrojen katyonunun varlığından dolayı biraz daha yüksek olduğundan.
Molekül yapısı
Aldehitlerin ve ketonların uzayda nasıl göründüğüne bakalım. Moleküllerinin yapısı birkaç noktada yansıtılabilir.
- Doğrudan fonksiyonel gruba dahil edilen karbon atomu, molekülün bir kısmının düz bir uzaysal şekle sahip olmasını sağlayan sp2 hibridizasyonuna sahiptir.
- Bu durumda C=O bağının polaritesi kuvvetlidir. Daha elektronegatif olan oksijen, yoğunluğun büyük kısmını alır ve kısmen negatif yükü kendi üzerinde yoğunlaştırır.
- Aldehitlerde O-H bağı da oldukça polarize olduğundan hidrojen atomunu hareketli kılar.
Sonuç olarak, böyle bir molekül yapısının söz konusu bileşiklerin hem oksitlenmesine hem de indirgenmesine izin verdiği ortaya çıktı. Yeniden dağıtılmış elektron yoğunluğuna sahip bir aldehit ve bir ketonun formülü, bu maddelerin katıldığı reaksiyonların ürünlerini tahmin etmeyi mümkün kılar.
Keşif ve çalışmanın tarihi
Birçok organik bileşik gibi, insanlar da aldehitleri ve ketonları izole etmeyi ve incelemeyi ancak 19. yüzyılda, vitalist görüşlerin tamamen çöktüğü ve bu bileşiklerin canlıların katılımı olmadan sentetik, yapay olarak oluşturulabileceğinin ortaya çıktığı 19. yüzyılda başardılar.
Ancak 1661 yılında R. Boyle, kalsiyum asetatı ısıya maruz bıraktığında aseton (dimetil keton) elde etmeyi başardı. Ancak bu maddeyi ayrıntılı olarak inceleyemedi, isimlendiremedi, diğerleri arasındaki sistematik konumunu belirleyemedi. Williamson ancak 1852'de bu konuyu tamamlayabildi ve ardından karbonil bileşikleri hakkındaki bilgilerin ayrıntılı gelişimi ve birikiminin tarihi başladı.

Fiziki ozellikleri
Aldehitlerin ve ketonların fiziksel özelliklerine bakalım. İlk olanlardan başlayalım.
- Metanalın toplanma halindeki ilk temsilcisi gazdır, sonraki on bir tanesi sıvıdır, 12'den fazla karbon atomu normal yapıdaki katı aldehitlerin parçasıdır.
- Kaynama noktası: C atomlarının sayısına bağlıdır; ne kadar çok varsa o kadar yüksektir. Bu durumda zincir ne kadar dallanırsa sıcaklık düşer.
- Sıvı aldehitler için viskozite, yoğunluk ve kırılma indeksleri aynı zamanda atom sayısına da bağlıdır. Ne kadar çok olursa, o kadar yüksek olurlar.
- Gaz halindeki ve sıvı aldehitler suda çok iyi çözünür, ancak katı olanlar bunu pratikte yapamaz.
- Temsilcilerin kokusu çok hoş, genellikle çiçek, parfüm ve meyve aromaları. Yalnızca karbon atomu sayısı 1-5 olan aldehitler güçlü ve hoş olmayan kokulu sıvılardır.
Ketonların özelliklerini belirtirsek ana olanları da vurgulayabiliriz.
- Toplu haller: alt temsilciler sıvılardır, daha büyük olanlar ise katı bileşiklerdir.
- Koku, tüm temsilcilerde keskin ve nahoştur.
- Sudaki çözünürlük düşük olanlar için iyidir ve organik çözücüler için hepsi için mükemmeldir.
- Uçucu maddeler, bu gösterge asitlerin ve alkollerinkini aşıyor.
- Kaynama ve erime noktaları molekülün yapısına bağlıdır ve zincirdeki karbon atomlarının sayısına bağlı olarak büyük ölçüde değişir.
Bunlar, fiziksel olanlar grubuna ait olan, söz konusu bileşiklerin ana özellikleridir.

Kimyasal özellikler
En önemlisi aldehit ve ketonların hangi maddelerle reaksiyona girdiği ve bu bileşiklerin kimyasal özellikleridir. Bu nedenle bunları mutlaka dikkate alacağız. İlk önce aldehitlerle ilgilenelim.
- Karşılık gelen karboksilik asitlere oksidasyon. Reaksiyon denkleminin genel formu şöyledir: R-COH + [O] = R-COOH. Aromatik temsilciler bu tür etkileşimlere daha kolay girebilmekte ve aynı zamanda endüstriyel açıdan büyük öneme sahip esterler oluşturabilmektedirler. Aşağıdaki oksitleyici maddeler kullanılır: oksijen, Tollens reaktifi, bakır (II) hidroksit ve diğerleri.
- Aldehitler doymuş monohidrik alkollere dönüşürken güçlü indirgeyici maddeler olarak kendilerini gösterirler.
- Asetaller ve hemiasetaller oluşturmak için alkollerle etkileşim.
- Özel reaksiyonlar polikondensasyondur. Bunun sonucunda kimya endüstrisi için önemli olan fenol-formaldehit reçineleri oluşur.
- Aşağıdaki reaktiflerle birkaç spesifik reaksiyon:
- hidroalkolik alkali;
- Grignard reaktifi;
- hidrosülfitler ve diğerleri.
Bu sınıftaki maddelere verilen kalitatif bir reaksiyon “gümüş ayna” reaksiyonudur. Sonuç olarak metalik indirgenmiş gümüş ve karşılık gelen karboksilik asit oluşur. Gümüş oksit veya Tollins reaktifinin amonyak çözeltisini gerektirir.

Ketonların kimyasal özellikleri
Alkoller, aldehitler ve ketonlar, hepsi oksijen içerdiğinden benzer özelliklere sahip bileşiklerdir. Bununla birlikte, zaten oksidasyon aşamasında, alkollerin en aktif ve en kolay etkilenen bileşikler olduğu ortaya çıkıyor. Ketonlar oksitlenmesi en zor olanlardır.
- Oksidatif özellikler. Bunun sonucunda ikincil alkoller oluşur.
- Hidrojenasyon aynı zamanda yukarıda bahsedilen ürünlere de yol açar.
- Keto-enol tautomerizmi, ketonların beta formunu almasına yönelik özel bir özelliktir.
- Beta-keto alkollerin oluşumu ile aldol yoğunlaşma reaksiyonları.
- Ketonlar ayrıca aşağıdakilerle de etkileşime girebilir:
- amonyak;
- hidrosiyanik asit;
- hidrosülfitler;
- hidrazin;
- ortosilik asit.
Açıkçası, bu tür etkileşimlerin tepkileri çok karmaşıktır, özellikle spesifik olanlar. Bunlar aldehitlerin ve ketonların sergilediği tüm temel özelliklerdir. Kimyasal özellikler önemli bileşiklerin birçok sentezinin temelini oluşturur. Bu nedenle endüstriyel proseslerde moleküllerin doğasını ve etkileşimler sırasındaki karakterlerini bilmek son derece gereklidir.
Aldehit ve ketonların katılma reaksiyonları
Bu tepkileri zaten incelemiştik ama onlara böyle bir isim vermemiştik. Karbonil grubunun aktivite sergilediği tüm etkileşimler, ekleme olarak sınıflandırılabilir. Daha doğrusu hareketli bir hidrojen atomu. Bu konuda daha iyi reaktiviteleri nedeniyle aldehitler tercih edilmesinin nedeni budur.
Nükleofilik sübstitüsyon yoluyla aldehitlerin ve ketonların reaksiyonları hangi maddelerle mümkündür? Bu:
- Hidrosiyanik asit, amino asitlerin sentezi için başlangıç materyali olan siyanohidrinleri üretir.
- Amonyak, aminler.
- Alkoller.
- Su.
- Sodyum hidrojen sülfat.
- Grignard reaktifi.
- Tioller ve diğerleri.
Ürünler insan faaliyetinin çeşitli alanlarında kullanıldığından, bu reaksiyonlar büyük endüstriyel öneme sahiptir.

Elde etme yöntemleri
Aldehitlerin ve ketonların sentezlendiği birkaç ana yöntem vardır. Laboratuvar ve endüstride üretim şu şekillerde ifade edilebilir.
- Laboratuvarlar da dahil olmak üzere en yaygın yöntem, karşılık gelen alkollerin oksidasyonudur: birincilden aldehitlere, ikincil olarak ketonlara. Aşağıdakiler oksitleyici madde görevi görebilir: kromatlar, bakır iyonları, potasyum permanganat. Reaksiyonun genel formu: R-OH + Cu (KMnO4) = R-COH.
- Endüstride, alkenlerin oksidasyonuna (oksosentez) dayanan bir yöntem sıklıkla kullanılır. Ana ajan, CO2 + H2 karışımı olan sentez gazıdır. Sonuç, zincirde bir karbon daha bulunan bir aldehittir. R=R-R + C02 + H2 = R-R-R-COH.
- Alkenlerin ozonla oksidasyonu - ozon ayrışımı. Sonuç aynı zamanda karışımda bir aldehitin yanı sıra bir keton olduğunu da gösteriyor. Ürünler zihinsel olarak oksijeni uzaklaştırılarak birleştirilirse hangi orijinal alkenin alındığı netleşecektir.
- Kucherov reaksiyonu - alkinlerin hidrasyonu. Zorunlu bir madde cıva tuzlarıdır. Aldehit ve ketonların sentezi için endüstriyel yöntemlerden biri. R≡R-R + Hg 2+ + H20 = R-R-COH.
- Dihalojenlenmiş hidrokarbonların hidrolizi.
- İndirgenme: karboksilik asitler, amidler, nitriller, asit klorürler, esterler. Sonuç olarak hem aldehit hem de keton oluşur.
- Karboksilik asit karışımlarının metal oksitler formundaki katalizörler üzerinde pirolizi. Karışım buharlı olmalıdır. İşin özü, karbondioksit ve su molekülleri arasındaki bölünmedir. Sonuç olarak bir aldehit veya keton oluşur.
Aromatik aldehitler ve ketonlar, bu bileşiklerin aromatik bir radikale (örneğin fenil) sahip olması nedeniyle başka yöntemlerle hazırlanır.
- Friedel-Crafts'a göre: başlangıç reaktifleri aromatik bir hidrokarbon ve dihalojenlenmiş bir keton içerir. Katalizör - ALCL 3. Sonuç olarak aromatik bir aldehit veya keton oluşur. İşlemin bir diğer adı da asilasyondur.
- Çeşitli ajanların etkisiyle tolüenin oksidasyonu.
- Aromatik karboksilik asitlerin indirgenmesi.
Doğal olarak endüstri, hammaddenin mümkün olduğu kadar ucuz olduğu ve katalizörlerin daha az toksik olduğu yöntemleri kullanmaya çalışıyor. Aldehitlerin sentezi için bu, alkenlerin oksijenle oksidasyonudur.

Endüstriyel Uygulamalar ve Önemi
Aldehitlerin ve ketonların kullanımı aşağıdaki gibi endüstrilerde gerçekleştirilir:
- farmasötikler;
- kimyasal sentez;
- ilaç;
- parfüm alanı;
- Gıda endüstrisi;
- boya ve vernik üretimi;
- plastik, kumaş vb. sentezi
Birden fazla alanı tanımlamak mümkündür, çünkü yılda yaklaşık 6 milyon ton formaldehit tek başına sentezlenmektedir! % 40'lık çözeltisine formalin adı verilir ve anatomik nesnelerin saklanması için kullanılır. Ayrıca ilaç, antiseptik ve polimer üretiminde de kullanılır.
Asetaldehit veya etanal da seri üretilen bir üründür. Dünyadaki yıllık tüketim miktarı yaklaşık 4 milyon ton olup, önemli ürünlerin oluştuğu birçok kimyasal sentezin temelini oluşturur. Örneğin:
- asetik asit ve anhidriti;
- selüloz asetat;
- ilaçlar;
- bütadien - kauçuğun temeli;
- asetat lifi.
Aromatik aldehitler ve ketonlar, hem gıda hem de parfüm olmak üzere birçok tatlandırıcının bileşenidir. Çoğunun çok hoş çiçek, narenciye, bitkisel aromaları var. Bu, bunların temelinde üretim yapılmasını mümkün kılar:
- çeşitli türde oda spreyleri;
- tuvalet ve parfüm suları;
- çeşitli temizlik ürünleri ve deterjanlar.
Bunlardan bazıları tüketime onaylanmış aromatik gıda katkı maddeleridir. Esansiyel yağlar, meyveler ve reçinelerdeki doğal içerikleri bu tür bir kullanımın mümkün olduğunu kanıtlıyor.
Bireysel temsilciler
Sitral gibi bir aldehit, yüksek viskoziteye ve güçlü limon aromasına sahip bir sıvıdır. Doğada ikincisinin uçucu yağlarında bulunur. Ayrıca okaliptüs, sorgum, kebap içerir.
Uygulama alanları iyi bilinmektedir:
- pediatri - kafa içi basıncında azalma;
- yetişkinlerde kan basıncının normalleşmesi;
- görme organları için bir ilacın bileşeni;
- birçok kokulu maddenin ayrılmaz bir parçası;
- antiinflamatuar ve antiseptik;
- retinol sentezi için hammaddeler;
- gıda amaçlı tatlandırıcı.





















 İleri geri
İleri geri
Dikkat! Slayt önizlemeleri yalnızca bilgilendirme amaçlıdır ve sunumun tüm özelliklerini temsil etmeyebilir. Bu çalışmayla ilgileniyorsanız, lütfen tam sürümünü indirin.
Dersin amacı: Aldehitlerin bileşimini, yapısını, sınıflandırılmasını, fiziksel ve kimyasal özelliklerini, hazırlanmasını ve kullanımını karakterize eder. Çalışılan organik bileşik sınıfları arasındaki ilişkiyi kurar. Aldehitlere verilen kalitatif reaksiyonları bilir.
Hayatımızın her yerinde organik kimyayla karşılaşırız: Kimya endüstrisinin ürünlerini yeriz, doğrudan onun sonuçlarına göre giyiniriz: asetat ipek, suni yün, suni deri ürünleri ve çok daha fazlası, kimya sayesinde karmaşık operasyonları (anestezi) gerçekleştirebilir, yaraları tedavi edebiliriz. boğazlara ve sadece antiseptik olarak etil alkolü seçtiğimiz enjeksiyonlar yapıyoruz.
Bugün sizi bir organik madde sınıfı olan aldehitlerle tanıştıracağız. Bugünkü dersimizde aldehitsiz yaşamın imkansız olduğunu kanıtlayacağız. Bilinen maddelerin bu konuyla ne kadar ilgili olduğunu öğrenelim: vanilin, deterjanlar, formaldehit, plastik, ayna, asetik asit
Yani aldehitler, moleküllerinde polar bir karbonil grubu içeren organik bileşiklerdir. Okso grubuyla ilişkili ikame edicilere bağlı olarak bu maddeler aldehitler ve ketonlara ayrılır. Aldehitlerde bir karbonil grubu bir hidrokarbon radikaline ve bir hidrojen atomuna bağlanırken, ketonlarda bir karbonil karbon iki hidrokarbon radikaline bağlanır.

Doymuş karbonil bileşiklerinin genel formülü CnH2nO
Önemsiz terminolojiye göre aldehitlerin isimleri genellikle karşılık gelen monokarboksilik asitlerin isimlerinden türetilir. Rasyonel terminolojiye göre dallı hidrokarbon zincirli aldehitlerin, asetaldehit türevleri olduğu kabul edilir. Sistematik terminolojiye göre, söz konusu bileşiklerin isimleri, - al son ekinin eklenmesiyle karşılık gelen alkanlardan türetilir.
Aldehit elde etme yöntemleri. Aldehit üretmenin ana yöntemleri alkollerin katalitik dehidrojenasyonu, alkinlerin hidrasyonu ve alkollerin oksidasyonudur.
Fiziki ozellikleri.
Homolog doymuş aldehit serisinin ilk üyesi HCOH renksiz bir gazdır ve sonraki birkaç aldehit sıvıdır. Daha yüksek aldehitler katıdır. Karbonil grubu aldehitlerin yüksek reaktivitesine neden olur. Aldehitlerin kaynama noktası molekül ağırlığının artmasıyla artar. Karşılık gelen alkollerden daha düşük bir sıcaklıkta kaynarlar; örneğin propiyonaldehit 48,8 0 C'de ve propil alkol 97,8 0 C'de.
Aldehitlerin yoğunluğu birden azdır. Formik ve asetaldehitler suda yüksek oranda çözünürken, aşağıdakiler daha az çözünür. Düşük aldehitlerin keskin, hoş olmayan bir kokusu varken, bazı yüksek aldehitlerin hoş bir kokusu vardır.
Aldehitlerin reaktivitesi aktif bir karbonil grubunun varlığına bağlıdır. Oksijen atomunun yüksek elektronegatifliği, karbonil grubundaki çift bağın güçlü polarizasyonunu ve hareketli a-elektronlarının oksijen atomuna doğru yer değiştirmesini destekler.

Aldehitlerin kimyasal özellikleri:
1. İlave reaksiyonları:
A) hidrojenasyon reaksiyonu
B) NaHSO3'ün ilave reaksiyonu
2. Oksidasyon reaksiyonları:
A) gümüş ayna reaksiyonu
B) trafik ışığı tepkisi
3. Polikondensasyon reaksiyonu
4. Polimerizasyon reaksiyonu
Karboksil grubuna kalitatif reaksiyon - aldehitlerin bakır (II) hidroksit - trafik ışığı ile oksidasyon reaksiyonu.
НСО + 2Cu(OH)2 = HCOOH +Cu2O +2H2O
“Gümüş Ayna Reaksiyonu”
Aynasız bir hayat düşünebiliyor musunuz? Sabah uyandığınızda yansımanızı göremiyor musunuz? Saçmalık gibi görünüyor, önemsiz bir şey. Ama ne zihinsel rahatsızlık! Masal karakterlerinin ceza olarak yansımalarından mahrum bırakılması boşuna değildir. Ayna nedir? Onun gücü nedir? Nereden geldi? Nasıl yapıldı?
Zaten bildiğimiz gibi, ilk gerçek aynalar bakır, altın ve gümüşten yapılmış, parlatılana kadar cilalanmış metal plakalardı. Bununla birlikte, bu tür aynaların büyük bir dezavantajı vardı - hızla karardılar ve havada karardılar. Bu durumdan nasıl bir çıkış yolu buldunuz? Çok sayıda deney, parlak metal katmanın cama da uygulanabileceğini göstermiştir. Yani, 1. yüzyılda. reklam kurşun veya kalay levhalara bağlanan cam levhalar olan cam aynalar üretmeye başladı. Bu şu şekilde yapıldı: Camı alkolle yıkadılar, talk pudrasıyla temizlediler ve ardından bir teneke levhayı yüzeye sıkıca bastırdılar. Üzerine cıva döküldü ve beklemeye bırakıldıktan sonra fazlası döküldü. Ortaya çıkan amalgam tabakası kapatıldı veya üzeri boyandı. Bu tür aynaların metal olanlardan çok daha dayanıklı olduğu ortaya çıktı, bu nedenle zanaat atölyeleri, yansıtıcı yüzeyi kalay amalgamdan (cıva Hg'de kalay Sn çözeltisi) yapılan cam aynaların üretimine geçti. Ancak cıva buharı çok zehirli olduğundan cıva aynalarının üretimi çok zararlıydı ve aynaların kendisi de cıva içeriyordu. Cıvalı aynaların yaşam alanlarında bulundurulması tehlikeliydi.
Bu nedenle bilim adamları cıvanın yerini alacak bir madde aramaya devam ettiler. Fransız kimyager François Ptizhan ve büyük Alman bilim adamı Justus Liebig tarafından keşfedildi. Liebig, gümüş kaplamalı cam aynalar yapmayı önerdi. Geliştirdiği yöntem aşağıdaki işlemlerden oluşuyordu. İlk olarak, sulu bir gümüş nitrat AgN03 çözeltisine sulu bir potasyum hidroksit KOH çözeltisi eklendi; bu, siyah-kahverengi bir gümüş oksit Ag20 çökeltisinin çökelmesine yol açtı.
2AgNO3 + 2KOH = Ag2O + 2KNO3 + H2O.
Çökelti süzüldü ve sulu bir amonyak NH3 çözeltisi ile karıştırıldı.
Ag20 + 4NH3 + H20 = 2 (OH).)
Gümüş oksit, karmaşık bir bileşik (amonyum oksit veya amin) - diamin gümüş(I) hidroksit oluşturmak üzere amonyaklı su içinde çözüldü. Daha sonra, yüzeylerinden biri iyice yağdan arındırılmış bir cam levha, elde edilen şeffaf çözeltiye daldırıldı ve formaldehit HCHO ilave edildi.
2(OH) + HCHO = 2Ag + HCOONH4 + 3NH3 + H2O.)
Formaldehit, camın temizlenmiş yüzeyinde biriken gümüşü azaltıp camı parlak, ayna benzeri bir kaplamayla kapladı.
Aldehit ve ketonların uygulanması.
Formaldehit. Homolog doymuş aldehit serisinin ilk üyesi formaldehit HCOH'dir. Ben buna metanal ve formik aldehit de diyorum. Karakteristik keskin kokusu olan renksiz bir gazdır. Kütle fraksiyonlarında %0,4 veya %40 metanal içeren sulu bir çözelti yaygın olarak kullanılmaktadır. Buna formaldehit denir. Formaldehit (formalin), kendine özgü keskin bir kokuya sahip, berrak, renksiz bir sıvı. Elleri yıkamak, aşırı terleme sırasında cildi yıkamak (%0,5–1), aletleri dezenfekte etmek (%0,5) ve duş yapmak için (1:2000–1:3000) dezenfektan ve koku giderici ajan olarak kullanılır. Lizoformun bir kısmı.
Kullanımı aynı zamanda proteinleri katlama yeteneğine de dayanmaktadır. Örneğin deri üretiminde formalinin tabaklama etkisi proteinin pıhtılaşmasıyla açıklanır, bunun sonucunda derinin sertleşmesi ve çürümemesi sağlanır. Biyolojik preparatların korunması için formaldehit kullanımı da aynı özelliğe dayanmaktadır. Formaldehit bazen tohumları dezenfekte etmek ve işlemek için kullanılır. Metanal bazı tıbbi maddelerin ve boyaların üretiminde kullanılmaktadır. Metanalın fenol ile reaksiyona sokulmasıyla elde edilen fenol-formaldehit reçinesini üretmek için büyük miktarda metanal kullanılır. Bu reçine çeşitli plastiklerin üretimi için gereklidir.

Çeşitli dolgu maddeleri ile birleştirilmiş fenol-formaldehit reçinesinden yapılan plastiklere fenolikler denir. Fenol-formaldehit reçinesinin aseton veya alkol içinde çözülmesiyle çeşitli vernikler elde edilir.
Metanal üre CO(NH)2 ile reaksiyona girdiğinde üre reçinesi elde edilir ve bundan aminoplastlar yapılır. Bu plastikler, elektrik mühendisliğine yönelik mikro gözenekli malzemeler (anahtarlar, prizler), mobilya ve iç dekorasyon malzemeleri, yonga levhalar ve suni mermer yapımında kullanılır. Isı ve ses yalıtımlı gözenekli malzemeler.
Asetaldehit CH 3 - SON, keskin, boğucu bir kokuya sahip, renksiz bir sıvıdır. Selüloz asetatlar, asetik ve peroksiasetik asitler, asetik anhidrit, etil asetat, glioksal, alkilaminler, bütanol, kloral üretiminde kullanılır. Formaldehit gibi aminler, fenol ve diğer maddelerle polikondensasyon reaksiyonlarına girerek endüstride yaygın olarak kullanılan sentetik reçineleri oluşturur.
Acı badem kokusuna sahip Benzaldehit C 6 H 5 C (H) = O, badem yağında ve okaliptüs esansiyel yağında bulunur. Sentetik benzaldehit, gıda aroması esanslarında ve parfüm bileşimlerinde kullanılır.
Alifatik aldehit CH3 (CH 2) 7 C (H) = O (önemsiz adı pelargonaldehittir) turunçgil bitkilerinin uçucu yağlarında bulunur, portakal kokusuna sahiptir ve gıda aroması olarak kullanılır.
Aromatik aldehit vanilin Tropikal vanilya bitkisinin meyvelerinde bulunan, şekerleme ürünlerinde yaygın olarak bilinen bir tatlandırıcı katkı maddesi olan sentetik vanilin artık daha sık kullanılmaktadır.
Limon kokulu Citral C 10 H 15 O (3,7-dimetil - 2,6-oktadienal) ev kimyasallarında kullanılır.
Krotonaldehit. Butanol, sorbik ve bütirik asitleri üretmek için kullanılan güçlü bir lakrimatör. Soya fasulyesi yağında bulunur. Aldehitlerin tıpta kullanımı.
Cinnamaldehyde tarçın yağında bulunur ve tarçın ağacının kabuğunun damıtılmasıyla elde edilir. Çubuk veya toz halinde yemek pişirmede kullanılır
Heksatropin (CH2) 6 N4 (heksametilentetramin), renksiz, kokusuz kristaller, suda kolayca çözünür. Sulu çözeltiler alkali reaksiyona sahiptir. Antiseptik etkiye sahiptir. Esas olarak idrar yollarının (sistit, piyelit) enfeksiyöz süreçleri için kullanılır. Eylem, ilacın formaldehit oluşumu ile asidik bir ortamda ayrışma yeteneğine dayanmaktadır. İlaç aç karnına reçete edilir. Kullanımı için endikasyonlar kolesistit, kolanjit, cilt ve gözlerin alerjik hastalıklarıdır (keratit, iridosiklit, vb.). İlaç böbrek parankiminde tahrişe neden olabilir; bu belirtiler ortaya çıkarsa ilaç kesilmelidir.
Akrolein. Çok sert plastiklerin üretiminde kullanılır. Akrolein ve sodyum tuzları toprağı yapılandıran emülgatörlerdir; lakton türevleri ise kağıt ve tekstillerin özelliklerini iyileştirir.
Bilginin genelleştirilmesi ve sistemleştirilmesi. Dersi özetlemek.
Böylece aldehitlerin ve ketonların çeşitli dönüşümlere katılma yetenekleri, çeşitli organik maddelerin sentezi için başlangıç bileşikleri olarak ana kullanımlarını belirledi: alkoller, karboksilik asitler ve bunların anhidritleri, ilaçlar (urotropin), polimer ürünleri (fenol-formaldehit reçineleri, poliformaldehit) ), her türlü koku (benzaldehit bazlı) ve boyaların üretiminde.
Ev ödevi.