Nima uchun aldegidlar oksidlanish reaksiyalari bilan tavsiflanadi? Aldegidlarning oksidlanishi: jarayon, yakuniy mahsulot. Aldegidlar va ketonlarni tayyorlash
1. R. Oksidlanish.
Aldegidlar karboksilik kislotalarga oson oksidlanadi. Oksidlovchi moddalar mis (II) gidroksid, oksid bo'lishi mumkinkumush, havo kislorodi:
Aromatik aldegidlarning oksidlanishi alifatiklarga qaraganda qiyinroq. Ketonlar, yuqorida aytib o'tilganidek, aldegidlarga qaraganda oksidlanish qiyinroq. Ketonlarning oksidlanishi og'ir sharoitlarda, kuchli oksidlovchi moddalar ishtirokida amalga oshiriladi. Karboksilik kislotalar aralashmasi natijasida hosil bo'ladi. Aldegidlarni ketonlardan qanday ajratish mumkin? Oksidlanish qobiliyatidagi farq aldegidlarni ketonlardan ajratib turadigan sifatli reaktsiyalar uchun asos bo'lib xizmat qiladi. Ko'pgina engil oksidlovchi moddalar aldegidlar bilan oson reaksiyaga kirishadi, lekin ketonlarga nisbatan inertdir. a) Murakkab ionlari + bo'lgan Tollens reaktivi (kumush oksidining ammiak eritmasi) aldegidlar bilan "kumush oyna" reaktsiyasini beradi. Bu metall kumush hosil qiladi. Kumush oksidi eritmasi tayyorlanadi nepo bilvosita d tajriba:
Tollens reaktivi aldegidlarni tegishli karboksilik kislotalarga oksidlaydi, ular ammiak ishtirokida ammoniy tuzlarini hosil qiladi. Ushbu reaksiyada oksidlovchi moddaning o'zi metall kumushga qaytariladi. Ushbu reaksiya jarayonida probirkaning devorlarida hosil bo'lgan yupqa kumush qoplama tufayli aldegidlarning kumush oksidning ammiak eritmasi bilan reaktsiyasi "kumush oyna" reaktsiyasi deb ataladi. CH3-CH=O)+2OH->CH3COONH4+2Ag+3NH3+H2O. Aldegidlar, shuningdek, mis (II) gidroksidning (Fehling reaktivi) yangi tayyorlangan och ko‘k ammiak eritmasini sariq rangli mis (I) gidroksidga aylantiradi, qizdirilganda parchalanib, mis (I) oksidining yorqin qizil cho‘kmasi ajralib chiqadi. CH3-CH=O + 2Cu(OH)2 - CH3COOH+2CuOH+H2O 2CuOH->Cu2O+H2O
2. R. Qo‘shilishlar
Gidrogenlash - vodorod qo'shilishi.
Karbonil birikmalari vodorod, litiy alyuminiy gidrid va natriy borgidrid bilan spirtlarga qaytariladi. Vodorod C = O bog'i orqali qo'shiladi. Reaktsiya alkenlarni gidrogenlashdan ko'ra qiyinroq: issiqlik, yuqori bosim va metall katalizatori (Pt, Ni) talab qilinadi:
3. Suv bilan o'zaro ta'siri Oh.
4. Spirtli ichimliklar bilan o'zaro ta'siri.
Aldegidlar spirtlar bilan reaksiyaga kirishganda, hemiatsetallar va atsetalar hosil bo'lishi mumkin. Gemiatsetallar - bitta uglerod atomida gidroksil va alkoksi guruhini o'z ichiga olgan birikmalar. Asetallarga molekulalarida ikkita alkoksi o'rnini bosuvchi uglerod atomi bo'lgan moddalar kiradi.
Asetallar, aldegidlardan farqli o'laroq, oksidlanishga nisbatan ancha chidamli. Spirtli ichimliklar bilan o'zaro ta'sirning qaytarilishi tufayli ular ko'pincha aldegid guruhini "himoya qilish" uchun organik sintezda qo'llaniladi.
4.Gidrosulfitlarning qo'shilishi.
Gidrosulfit NaHSO3, shuningdek, karbonil birikmasi qayta tiklanishi mumkin bo'lgan kristalli hosila hosil qilish uchun C=O bog'lanishiga qo'shiladi. Bisulfit hosilalari aldegidlar va ketonlarni tozalash uchun ishlatiladi.
Katalizatorlar ishtirokida fenolning formaldegid bilan polikondensatsiyasi natijasida fenolformaldegid smolalari hosil bo'lib, ulardan plastmassalar - fenol plastmassalar (bakelitlar) olinadi. Fenolik plastmassalar ko'plab sanoat tarmoqlarida rangli va qora metallarning eng muhim o'rnini bosuvchi hisoblanadi. Ulardan ko'plab iste'mol tovarlari, elektr izolyatsiya materiallari va qurilish qismlari ishlab chiqariladi. Fenol-formaldegid smolasining bir qismi quyida ko'rsatilgan:
Aldegidlar va ketonlarni ishlab chiqarish uchun boshlang'ich birikmalar uglevodorodlar, galogen hosilalari, spirtlar va kislotalar bo'lishi mumkin.
Karbonil birikmalarini qo'llash
Formaldegid bakelit, terini tozalash, dezinfektsiyalash va urug'larni tayyorlash kabi plastmassalarni ishlab chiqarish uchun ishlatiladi. Yaqinda mamlakatimizda yuqori kimyoviy va termik barqarorlikka ega poliformaldegid (-CH2-O-)n olish usuli ishlab chiqildi.
Bu ko'p hollarda metallarni almashtirishga qodir bo'lgan eng qimmatli strukturaviy plastmassa. Asetaldegid sirka kislotasi va ba'zi plastmassalarni ishlab chiqarish uchun ishlatiladi. Aseton ko'plab birikmalarni sintez qilish uchun boshlang'ich material sifatida ishlatiladi (masalan, polimerizatsiyasi plexiglass ishlab chiqaradigan metil metakrilat); u erituvchi sifatida ham ishlatiladi.
Organik moddaning kimyoviy formulasini aniqlash uchun uning kichik massasi yondiriladi, so'ngra yonish mahsulotlari tekshiriladi. Masalan, yonayotganda 3,75 g formaldegid oldi 2,25 g suv bug'lari va 5,5 g uglerod oksidi (IV). Formaldegidning vodorod jihatidan bug 'zichligi aniqlandi 15 . Ushbu ma'lumotlardan foydalanib, qancha gramm uglerod va vodorod borligini toping 3,75 g formaldegid:
M(CO2) = 12 + 32 = 44; M = 44 g/mol
44 g CO 2 tarkibida 12 g mavjud
5,5 g CO 2 "x 1
44 ÷ 5,5 = 12 ÷ x 1; x 1 = (5,5 12) / 44 = 1,5; m (C) = 1,5 g
M (H 2 O) = 2 + 16 = 18; M = 18 g/mol
18 g H 2 O 2 g ni o'z ichiga oladi
2,25 g H 2 O "x 2
18 ÷ 2,25 = 2 ÷ x 2; x 2 = (2,25 2) / 18 = 0,25; m (H) = 0,25 g
Uglerod va vodorodning umumiy massasini toping:
X 1 + x 2 = 1,5 + 0,25 = 1,75
Yonish uchun 3,75 g formaldegid olinganligi sababli kislorodning massasini hisoblash mumkin:
3,75 - 1,75 = 2; m(O) = 2 g
Eng oddiy formulani aniqlang:
C: H: O = (1,5 ÷ 12) : (0,25 ÷ 1) : (2 ÷ 16) = 0,125: 0,25: 0,125 = 1: 2: 1
Shuning uchun o'rganilayotgan moddaning eng oddiy formulasi CH2O.
Formaldegidning vodorod bug'ining zichligini bilib, uning molyar massasini hisoblang:
M = 2D (H 2) = 2 15 = 30; M = 30 g/mol
Eng oddiy formuladan foydalanib, molyar massani toping:
M (CH 2 O) = 12 + 2 + 16 = 30; M(CH2O) = 30 g/mol
Shuning uchun formaldegidning molekulyar formulasi CH2O
Formaldegid molekulasida uglerod va vodorod atomlari o'rtasida s bog', uglerod va kislorod atomlari o'rtasida bitta s va bitta p bog' mavjud.
Izomeriya va nomenklatura
Aldegidlar uglevodorod radikalining izomeriyasi bilan tavsiflanadi. U tekis yoki tarvaqaylab zanjirga ega bo'lishi mumkin. Aldegidlarning nomlari oksidlanish jarayonida aylanadigan tegishli organik kislotalarning tarixiy nomlaridan kelib chiqadi (formaldegid, asetaldegid, propionaldegid va boshqalar). Xalqaro nomenklaturaga ko'ra, aldegidlarning nomlari tegishli uglevodorodlarning nomlaridan qo'shimcha qo'shilgan holda olingan. -al.
Aldegidlarning eng muhim vakillari.
Metanal yoki formaldegid*
Etanal yoki asetaldegid*
Propanal
Butanal
2-metilpropanal
Pentanal
Geksanal

Kvitansiya
IN laboratoriyalar aldegidlar birlamchi spirtlarning oksidlanishi natijasida olinadi. Oksidlovchi moddalar sifatida ishlatiladi mis (II) oksidi, vodorod peroksid va kislorodni chiqaradigan boshqa moddalar. Umuman olganda, buni quyidagicha ko'rsatish mumkin: 
IN sanoat aldegidlar turli usullar bilan tayyorlanadi. Uni olish iqtisodiy jihatdan eng foydali hisoblanadi metanal maxsus reaktorda metanning atmosfera kislorodi bilan bevosita oksidlanishi.
Metanal oksidlanishining oldini olish uchun reaksiya zonasidan yuqori tezlikda metan va havo aralashmasi o'tkaziladi.
Metanol, shuningdek, metanolni oksidlash, uning bug'ini havo bilan birga issiq mis yoki kumush to'rli reaktor orqali o'tkazish orqali olinadi. Biroq, bu usul iqtisodiy jihatdan kamroq foyda keltiradi.
Etanal katalizator sifatida simob tuzlari ishtirokida asetilenni gidratlash orqali ham olish mumkin ( M. G. Kucherovning reaktsiyasi). Bu reaksiyada katalizator sifatida zaharli moddalar - simob tuzlari ishlatilganligi sababli, yaqinda atsetaldegid olishning yangi usuli ishlab chiqildi: etilenning havo bilan aralashmasi mis, temir va palladiy tuzlarining suvli eritmasidan o'tkaziladi.
Jismoniy xususiyatlar
Metanal- o'tkir hidli rangsiz gaz. Metanalning suvdagi eritmasi (35 - 40%) formalin deyiladi. Aldegidlar qatorining qolgan a'zolari suyuqliklar, yuqorilari esa qattiq moddalardir.
Kimyoviy xossalari
Aldegidlar uchun eng tipik reaksiyalar oksidlanish va qo'shilish.
1. Oksidlanish reaksiyalari
A) Aldegidlarga sifatli reaksiya reaksiya hisoblanadi "Kumush oyna". Uni amalga oshirish uchun toza probirkaga quying kumush (I) oksidning ammiak eritmasi(Ag 2 O suvda amalda erimaydi, ammo ammiak bilan eriydigan OH birikmasini hosil qiladi), unga aldegid eritmasi qo'shiladi va qizdiriladi.
Reduksiyalangan kumush probirka devorlariga yaltiroq qoplama shaklida joylashadi va aldegid tegishli organik kislotaga oksidlanadi.
b) Yana bir xarakterli reaksiya aldegidlarning oksidlanishidir mis (II) gidroksidi. Agar mis (II) gidroksidning ko'k cho'kmasiga aldegid eritmasi qo'shilsa va aralashma qizdirilsa, birinchi navbatda mis (I) gidroksidning sariq cho'kmasi paydo bo'ladi, bu esa keyingi qizdirilganda hosil bo'ladi. qizil mis (I) oksidi. Ushbu reaksiyada oksidlovchi vosita oksidlanish raqamiga ega misdir +2
, bu oksidlanish holatiga tushadi +1
.
2. Qo'shilish reaktsiyalari
Qo'shilish reaktsiyalari mavjudligidan kelib chiqadi p obligatsiyalari, bu osonlikcha buziladi. Uning yorilishi joyida atomlar va atom guruhlari biriktiriladi. Misol uchun, metanal va vodorod aralashmasi qizdirilgan katalizatordan o'tkazilsa, u metanolga qaytariladi.
Vodorod va boshqa aldegidlar ham xuddi shunday qo'shiladi.
TA’RIF
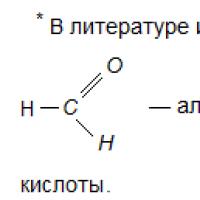
Aldegidlar– CH = O funktsional guruhini o'z ichiga olgan karbonil birikmalar sinfiga mansub organik moddalar, bu karbonil deb ataladi.
Toʻyingan aldegidlar va ketonlarning umumiy formulasi C n H 2 n O. Aldegidlarning nomlarida –al qoʻshimchasi mavjud.
Aldegidlarning eng oddiy vakillari formaldegid (formaldegid) -CH 2 = O, asetaldegid (sirka aldegid) - CH 3 -CH = O. Tsiklik aldegidlar mavjud, masalan, sikloheksan-karbaldegid; aromatik aldegidlar arzimas nomlarga ega - benzaldegid, vanillin.
Karbonil guruhidagi uglerod atomi sp 2 gibridlanish holatida boʻlib, 3s bogʻ hosil qiladi (ikkita C-H va bitta C-O bogʻ). p-bog' uglerod va kislorod atomlarining p elektronlari tomonidan hosil bo'ladi. C=O qo‘sh bog‘lanish s va p bog‘larning birikmasidir. Elektron zichligi kislorod atomi tomon siljiydi.
Aldegidlar uglerod skeletining izomeriyasi, shuningdek, ketonlar bilan sinflararo izomerizm bilan tavsiflanadi:
CH 3 -CH 2 -CH 2 -CH = O (butanal);
CH 3 -CH (CH 3) -CH = O (2-metilpentanal);
CH 3 -C (CH 2 -CH 3) = O (metil etil keton).
Aldegidlarning kimyoviy xossalari
Aldegid molekulalari bir nechta reaksiya markazlariga ega: nukleofil qo'shilish reaktsiyalarida ishtirok etadigan elektrofil markaz (karbonil uglerod atomi); asosiy markaz - yolg'iz elektron juftlari bo'lgan kislorod atomi; Kondensatsiya reaktsiyalari uchun javob beradigan a-CH kislota markazi; oksidlanish reaksiyalarida uzilgan C-H aloqasi.
1. Qo‘shish reaksiyalari:
- geme-diollar hosil bo'lgan suv
R-CH = O + H 2 O ↔ R-CH(OH)-OH;
— hemiatsetallar hosil qiluvchi spirtlar
CH 3 -CH = O + C 2 H 5 OH ↔CH 3 -CH(OH)-O-C 2 H 5;
— ditiotsetallar hosil qiluvchi tiollar (kislotali muhitda)
CH 3 -CH = O + C 2 H 5 SH ↔ CH 3 -CH(SC 2 H 5) -SC 2 H 5 + H 2 O;
— natriy gidrosulfit, natriy a-gidroksisulfonatlar hosil bo'lishi bilan
C 2 H 5 -CH = O + NaHSO 3 ↔ C 2 H 5 -CH(OH)-SO 3 Na;
- N-almashtirilgan iminlar hosil bo'lgan aminlar (Schiff asoslari)
C 6 H 5 CH = O + H 2 NC 6 H 5 ↔ C 6 H 5 CH = NC 6 H 5 + H 2 O;
- gidrazinlar gidrazonlar hosil qiladi
CH 3 -CH = O + 2 HN-NH 2 ↔ CH 3 -CH = N-NH 2 + H 2 O;
— nitril hosil qiluvchi gidrosiyan kislotasi
CH 3 -CH = O + HCN ↔ CH 3 -CH(N)-OH;
- tiklanish. Aldegidlar vodorod bilan reaksiyaga kirishganda, birlamchi spirtlar olinadi:
R-CH = O + H 2 → R-CH 2 -OH;
2. Oksidlanish
- "kumush oyna" reaktsiyasi - aldegidlarning kumush oksidning ammiak eritmasi bilan oksidlanishi
R-CH = O + Ag 2 O → R-CO-OH + 2Ag↓;
- aldegidlarning mis (II) gidroksid bilan oksidlanishi, buning natijasida mis (I) oksidining qizil cho'kmasi hosil bo'ladi.
CH 3 -CH = O + 2Cu(OH) 2 → CH 3 -COOH + Cu 2 O↓ + 2H 2 O;
Bu reaksiyalar aldegidlarga sifatli reaksiyalardir.
Aldegidlarning fizik xossalari
Aldegidlarning gomologik qatorining birinchi vakili formaldegid (chumoli aldegid) - gazsimon modda (n.s.), tarmoqlanmagan tuzilishi va tarkibi C 2 -C 12 aldegidlari - suyuqliklar, C 13 va undan uzoqroq - qattiq moddalar. To'g'ri aldegid tarkibida qancha ko'p uglerod atomlari bo'lsa, uning qaynash nuqtasi shunchalik yuqori bo'ladi. Aldegidlarning molekulyar og'irligi oshishi bilan ularning yopishqoqligi, zichligi va sinishi indeksining qiymatlari ortadi. Formaldegid va asetaldegid cheksiz miqdorda suv bilan aralashishi mumkin, ammo uglevodorod zanjirining o'sishi bilan aldegidlarning bu qobiliyati pasayadi. Pastki aldegidlar o'tkir hidga ega.
Aldegidlarni tayyorlash
Aldegidlarni olishning asosiy usullari:
- alkenlarning gidroformillanishi. Bu reaksiya alkenga CO va vodorodning ba'zi VIII guruh metallarining karbonillari, masalan, oktakarbonil dikobalt (Co 2 (CO) 8) ishtirokida qo'shilishidan iborat bosim 300 atm
CH 3 -CH = CH 2 + CO +H 2 →CH 3 -CH 2 -CH 2 -CH = O + (CH 3) 2 CHCH = O;
- alkinlarning hidratsiyasi. Alkinlarning suv bilan o'zaro ta'siri simob (II) tuzlari ishtirokida va kislotali muhitda sodir bo'ladi:
HC≡CH + H 2 O → CH 3 -CH = O;
- birlamchi spirtlarning oksidlanishi (reaksiya qizdirilganda sodir bo'ladi)
CH 3 -CH 2 -OH + CuO → CH 3 -CH = O + Cu + H 2 O.
Aldegidlarni qo'llash
Aldegidlar turli mahsulotlarni sintez qilish uchun xom ashyo sifatida keng qo'llaniladi. Shunday qilib, formaldegiddan (katta ishlab chiqarish) turli qatronlar (fenol-formaldegid va boshqalar) va dorilar (urotropin) olinadi; asetaldegid sirka kislotasi, etanol, turli xil piridin hosilalari va boshqalarni sintez qilish uchun xom ashyo hisoblanadi. Ko'pgina aldegidlar (butirik, doljin va boshqalar) parfyumeriya tarkibiga kiradi.
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | C n H 2 n +2 ni bromlash orqali biz 9,5 g monobromid oldik, suyultirilgan NaOH eritmasi bilan ishlov berilganda kislorodli birikmaga aylanadi. Uning havo bilan bug'lari issiq mis to'r orqali o'tadi. Hosil bo'lgan yangi gazsimon moddaga Ag 2 O ning ammiak eritmasining ko'pligi bilan ishlov berilganda 43,2 g cho'kma ajralib chiqdi. Qaysi uglevodorod va qancha miqdorda olingan, agar bromlash bosqichida hosil 50% bo'lsa, qolgan reaksiyalar miqdoriy jihatdan davom etadi. |
| Yechim | Barcha sodir bo'ladigan reaksiyalar tenglamalarini yozamiz: C n H 2n+2 + Br 2 = C n H 2n+1 Br + HBr; C n H 2n+1 Br + NaOH = C n H 2n+1 OH + NaBr; C n H 2n+1 OH → R-CH = O; R-CH = O + Ag 2 O → R-CO-OH + 2Ag↓. Oxirgi reaksiyada ajralib chiqadigan cho'kma kumushdir, shuning uchun siz kumushning ajralib chiqadigan moddaning miqdorini topishingiz mumkin: M(Ag) = 108 g/mol; v (Ag) = m / M = 43,2/108 = 0,4 mol. Muammoning shartlariga ko'ra, 2-reaksiyada olingan moddani issiq metall to'rdan o'tkazgandan so'ng, gaz hosil bo'ldi va yagona gaz - aldegid - metanal, shuning uchun boshlang'ich modda metan hisoblanadi. CH 4 + Br 2 = CH 3 Br + HBr. Bromometan moddasining miqdori: v (CH 3 Br) = m / M = 9,5/95 = 0,1 mol. Keyin, 50% bromometan hosili uchun zarur bo'lgan metan moddasining miqdori 0,2 mol. M(CH 4) = 16 g/mol. Shunday qilib, metanning massasi va hajmi: m (CH 4) = 0,2 × 16 = 3,2 g; V (CH 4) = 0,2 × 22,4 = 4,48 l. |
| Javob | Metan massasi - og'irligi 3,2 g, metan hajmi - 4,48 l |
2-MISA
| Mashq qilish | Quyidagi o'zgarishlarni amalga oshirish uchun ishlatilishi mumkin bo'lgan reaksiya tenglamalarini yozing: buten-1 → 1-bromobutan + NaOH → A – H 2 → B + OH → C + HCl → D. |
| Yechim | Buten-1 dan 1-bromobutan olish uchun R 2 O 2 peroksid birikmalari ishtirokida gidrobromlanish reaktsiyasini o'tkazish kerak (reaksiya Markovnikov qoidasiga zid keladi): CH 3 -CH 2 -CH = CH 2 + HBr → CH 3 -CH 2 -CH 2 -CH 2 Br. Ishqorning suvli eritmasi bilan o'zaro ta'sirlashganda, 1-bromobutan butanol-1 (A) hosil qilish uchun gidrolizga uchraydi: CH 3 -CH 2 -CH 2 -CH 2 Br + NaOH → CH 3 -CH 2 -CH 2 -CH 2 OH + NaBr. Butanol-1, dehidrogenlanganda, aldegid - butanal (B) hosil qiladi: CH 3 -CH 2 -CH 2 -CH 2 OH → CH 3 -CH 2 -CH 2 -CH = O. Kumush oksidning ammiak eritmasi butanalni ammoniy tuzi - ammoniy butirat (C) ga oksidlaydi: CH 3 -CH 2 -CH 2 -CH = O + OH →CH 3 -CH 2 -CH 2 -COONH 4 + 3NH 3 + 2Ag↓ +H 2 O. Ammoniy butirat xlorid kislota bilan reaksiyaga kirishib, butir kislotasini (D) hosil qiladi: CH 3 -CH 2 -CH 2 -COONH 4 + HCl → CH 3 -CH 2 -CH 2 -COOH + NH 4 Cl. |
Kislorodli organik birikmalar orasida ikkita sinf moddalar katta ahamiyatga ega bo'lib, ular tuzilishi va xossalari o'xshashligi uchun doimo birgalikda o'rganiladi. Bular aldegidlar va ketonlardir. Aynan shu molekulalar ko'plab kimyoviy sintezlarning asosini tashkil qiladi va ularning tuzilishi o'rganish mavzusi bo'lish uchun etarlicha qiziqarli. Keling, ushbu birikmalar sinflari nima ekanligini batafsil ko'rib chiqaylik.
Aldegidlar va ketonlar: umumiy xarakteristikalar
Kimyoviy nuqtai nazardan, aldegidlar sinfi karbonil deb ataladigan -SON funktsional guruhining bir qismi sifatida kislorodni o'z ichiga olgan organik molekulalarni o'z ichiga olishi kerak. Bu holda umumiy formula quyidagicha ko'rinadi: R-COH. O'z tabiatiga ko'ra, ular cheklovchi va cheklanmagan birikmalar bo'lishi mumkin. Ular orasida alifatiklar bilan bir qatorda aromatik vakillar ham bor. Radikal zanjirdagi uglerod atomlarining soni bir (formaldegid yoki metanal) dan bir necha o'nlabgacha bo'lgan juda keng tarqalgan.
Ketonlar tarkibida karbonil guruhi -CO ham mavjud, lekin u vodorod kationiga emas, balki zanjirga kiritilgandan farqli yoki bir xil bo'lgan boshqa radikal bilan bog'langan. Umumiy formula quyidagicha ko'rinadi: R-CO-R,. Ko'rinib turibdiki, aldegidlar va ketonlar ushbu tarkibning funktsional guruhi mavjudligida o'xshashdir.
Ketonlar ham to'yingan va to'yinmagan bo'lishi mumkin va ko'rsatilgan xususiyatlar yaqindan bog'liq bo'lgan sinfga o'xshaydi. Molekulalarning tarkibini ko'rsatish va ko'rib chiqilayotgan moddalar formulalari uchun qabul qilingan belgilarni aks ettirish uchun bir nechta misollar keltirilishi mumkin.
- Aldegidlar: metanal - HCOH, butanal - CH 3 -CH 2 -CH 2 -CH, fenilatsetik - C 6 H 5 -CH 2 -CH.
- Ketonlar: aseton yoki dimetil keton - CH 3 -CO-CH 3, metil etil keton - CH 3 -CO-C 2 H 5 va boshqalar.
Shubhasiz, bu birikmalarning nomi ikki shaklda hosil bo'ladi:
- ratsional nomenklatura bo'yicha tarkibga kiritilgan radikallar va sinf qo'shimchasi -al (aldegidlar uchun) va -on (ketonlar uchun);
- ahamiyatsiz, tarixiy asosli.
Har ikkala sinf moddalar uchun umumiy formulani keltirsak, ular bir-birining izomerlari ekanligi ayon bo'ladi: C n H 2n O. Ularning o'zi quyidagi izomeriya turlari bilan tavsiflanadi:

Ikkala sinf vakillarini farqlash uchun sifatli reaktsiyalar qo'llaniladi, ularning aksariyati aldegidni aniqlashga imkon beradi. Ushbu moddalarning kimyoviy faolligi vodorod kationi mavjudligi sababli biroz yuqoriroq bo'lgani uchun.
Molekula tuzilishi
Keling, aldegidlar va ketonlarning kosmosda qanday ko'rinishini ko'rib chiqaylik. Ularning molekulalarining tuzilishi bir necha nuqtalarda aks ettirilishi mumkin.
- Funktsional guruhga bevosita kiritilgan uglerod atomi sp 2 gibridlanishiga ega, bu esa molekulaning bir qismini tekis fazoviy shaklga ega bo'lishiga imkon beradi.
- Bunday holda, C=O bog'lanishning qutbliligi kuchli. Elektromanfiyroq bo'lgan kislorod zichlikning asosiy qismini oladi va qisman manfiy zaryadni o'zida to'playdi.
- Aldegidlarda O-H aloqasi ham yuqori polarizatsiyalangan bo'lib, bu vodorod atomini harakatchan qiladi.
Natijada, molekulalarning bunday tuzilishi ko'rib chiqilayotgan birikmalarning ham oksidlanishiga, ham qaytarilishiga imkon beradi. Qayta taqsimlangan elektron zichlikka ega bo'lgan aldegid va keton formulasi ushbu moddalar ishtirok etadigan reaktsiyalar mahsulotlarini taxmin qilish imkonini beradi.
Kashfiyot va o'rganish tarixi
Ko'pgina organik birikmalar singari, odamlar aldegidlar va ketonlarni ajratish va o'rganishga faqat 19-asrda, vitalistik qarashlar butunlay yo'q bo'lib ketgan va bu birikmalarni tirik mavjudotlar ishtirokisiz sintetik, sun'iy yo'l bilan hosil qilish mumkinligi ayon bo'lganida muvaffaqiyat qozongan.
Biroq, 1661 yilda R. Boyl kaltsiy asetatiga issiqlik ta'sirida aseton (dimetil keton) olishga muvaffaq bo'ldi. Ammo u ushbu moddani batafsil o'rgana olmadi va uni nomlay olmadi, uning boshqalar orasida tizimli o'rnini aniqlay olmadi. Faqat 1852 yilda Uilyamson bu masalani oxiriga etkazishga muvaffaq bo'ldi, shundan so'ng karbonil birikmalari haqidagi bilimlarning batafsil rivojlanishi va to'planishi tarixi boshlandi.

Jismoniy xususiyatlar
Aldegid va ketonlarning fizik xossalarini ko'rib chiqamiz. Keling, birinchilardan boshlaylik.
- Metanalning agregat holatidagi birinchi vakili gaz, keyingi o'n bittasi suyuqlikdir, 12 dan ortiq uglerod atomlari normal tuzilishdagi qattiq aldegidlarning bir qismidir.
- Qaynash nuqtasi: C atomlari soniga bog'liq bo'lsa, qancha ko'p bo'lsa, u shunchalik yuqori bo'ladi. Bunday holda, zanjir qanchalik tarvaqaylab ketgan bo'lsa, harorat pasayadi.
- Suyuq aldegidlar uchun yopishqoqlik, zichlik va sindirish ko'rsatkichlari ham atomlar soniga bog'liq. Qanchalik ko'p bo'lsa, ular shunchalik yuqori bo'ladi.
- Gazsimon va suyuq aldegidlar suvda juda yaxshi eriydi, ammo qattiq moddalar buni amalga oshira olmaydi.
- Vakillarning hidi juda yoqimli, ko'pincha gullar, atirlar va mevalarning xushbo'y hidlari. Faqat uglerod atomlari soni 1-5 ta bo'lgan aldegidlar kuchli va yoqimsiz hidli suyuqliklardir.
Agar ketonlarning xususiyatlarini belgilasak, asosiylarini ham ajratib ko'rsatishimiz mumkin.
- Agregat holatlar: quyi vakillari suyuqliklar, massivlari esa qattiq birikmalardir.
- Hidi barcha vakillarda o'tkir va yoqimsiz.
- Suvda eruvchanligi pastroqlar uchun yaxshi, organik erituvchilarda esa hamma uchun yaxshi.
- Uchuvchi moddalar, bu ko'rsatkich kislotalar va spirtlardan oshib ketadi.
- Qaynash va erish nuqtalari molekulaning tuzilishiga bog'liq va zanjirdagi uglerod atomlari soniga qarab juda katta farq qiladi.
Bular ko'rib chiqilayotgan birikmalarning asosiy xossalari bo'lib, ular fizik birikmalar guruhiga kiradi.

Kimyoviy xossalari
Eng muhimi, aldegidlar va ketonlarning nima bilan reaksiyaga kirishishi va bu birikmalarning kimyoviy xossalari. Shuning uchun biz ularni albatta ko'rib chiqamiz. Birinchidan, aldegidlar bilan shug'ullanamiz.
- Tegishli karboksilik kislotalarga oksidlanish. Reaksiya tenglamasining umumiy shakli: R-COH + [O] = R-COOH. Xushbo'y vakillar bunday o'zaro ta'sirlarga yanada oson kirishadi va ular sanoatda katta ahamiyatga ega bo'lgan efirlarni hosil qilishga qodir. Quyidagi oksidlovchi moddalar ishlatiladi: kislorod, Tollens reaktivi, mis (II) gidroksid va boshqalar.
- Aldegidlar to'yingan monohidrik spirtlarga aylanib, kuchli qaytaruvchi moddalar sifatida namoyon bo'ladi.
- Asetallar va hemiatsetallarni hosil qilish uchun spirtli ichimliklar bilan o'zaro ta'sir qilish.
- Maxsus reaktsiyalar polikondensatsiyadir. Natijada kimyo sanoati uchun muhim bo'lgan fenol-formaldegid smolalari hosil bo'ladi.
- Quyidagi reagentlar bilan bir nechta o'ziga xos reaktsiyalar:
- gidrospirtli gidroksidi;
- Grignard reaktivi;
- gidrosulfitlar va boshqalar.
Ushbu toifadagi moddalarga sifatli reaktsiya "kumush oyna" reaktsiyasidir. Natijada metall qaytarilgan kumush va tegishli karboksilik kislota hosil bo'ladi. Bu kumush oksidi yoki Tollins reaktivining ammiak eritmasini talab qiladi.

Ketonlarning kimyoviy xossalari
Spirtli ichimliklar, aldegidlar va ketonlar o'xshash xususiyatlarga ega birikmalardir, chunki ularning barchasi kislorod o'z ichiga oladi. Biroq, oksidlanish bosqichida spirtli ichimliklar eng faol va oson ta'sir qiluvchi birikmalar ekanligi ayon bo'ladi. Ketonlar eng qiyin oksidlanishdir.
- Oksidlanish xossalari. Natijada, ikkilamchi spirtlar hosil bo'ladi.
- Gidrogenatsiya ham yuqorida aytib o'tilgan mahsulotlarga olib keladi.
- Keto-enol tautomerizmi ketonlarning beta shaklini olish uchun maxsus o'ziga xos xususiyatidir.
- Beta-keto spirtlarining hosil bo'lishi bilan aldol kondensatsiya reaktsiyalari.
- Ketonlar shuningdek, quyidagilar bilan o'zaro ta'sir qilishi mumkin:
- ammiak;
- gidrosiyan kislotasi;
- gidrosulfitlar;
- gidrazin;
- ortosilik kislota.
Shubhasiz, bunday o'zaro ta'sirlarning reaktsiyalari juda murakkab, ayniqsa o'ziga xos bo'lganlar. Bularning barchasi aldegidlar va ketonlar ko'rsatadigan asosiy xususiyatlardir. Kimyoviy xususiyatlar muhim birikmalarning ko'plab sintezlari asosida yotadi. Shuning uchun molekulalarning tabiatini va ularning o'zaro ta'sirida xarakterini bilish sanoat jarayonlarida juda zarurdir.
Aldegidlar va ketonlarning qo'shilish reaksiyalari
Biz bu reaktsiyalarni allaqachon ko'rib chiqdik, lekin ularga bunday nom bermadik. Karbonil guruhi faollik ko'rsatgan barcha o'zaro ta'sirlarni qo'shilish deb tasniflash mumkin. To'g'rirog'i, mobil vodorod atomi. Shuning uchun bu masalada yaxshi reaktivlik tufayli aldegidlarga ustunlik beriladi.
Aldegidlar va ketonlarning qaysi moddalar bilan nukleofil almashinish reaksiyalari mumkin? Bu:
- Hidrosiyan kislotasi aminokislotalarni sintez qilish uchun boshlang'ich material - siyanogidrinlarni ishlab chiqaradi.
- Ammiak, aminlar.
- Spirtli ichimliklar.
- Suv.
- Natriy vodorod sulfat.
- Grignard reaktivi.
- Tiols va boshqalar.
Ushbu reaktsiyalar katta sanoat ahamiyatiga ega, chunki mahsulotlar inson faoliyatining turli sohalarida qo'llaniladi.

Qabul qilish usullari
Aldegidlar va ketonlarni sintez qilishning bir necha asosiy usullari mavjud. Laboratoriyada va sanoatda ishlab chiqarishni quyidagi ko'rinishlarda ifodalash mumkin.
- Eng keng tarqalgan usul, shu jumladan laboratoriyalarda, tegishli spirtlarning oksidlanishidir: birlamchi aldegidlar, ikkinchi darajali ketonlar. Quyidagilar oksidlovchi vosita sifatida harakat qilishi mumkin: xromatlar, mis ionlari, kaliy permanganat. Reaksiyaning umumiy shakli: R-OH + Cu (KMnO 4) = R-COH.
- Sanoatda alkenlarning oksidlanishiga asoslangan usul - oksosintez ko'pincha qo'llaniladi. Asosiy vosita - sintez gazi, CO 2 + H 2 aralashmasi. Natijada zanjirda yana bitta uglerodli aldegid hosil bo'ladi. R=R-R + CO 2 + H 2 = R-R-R-COH.
- Alkenlarning ozon bilan oksidlanishi - ozonoliz. Natija, shuningdek, aldegidni, balki aralashmada ketonni ham ko'rsatadi. Agar mahsulotlar kislorodni olib tashlash orqali aqliy ravishda birlashtirilsa, qaysi asl alken olinganligi aniq bo'ladi.
- Kucherov reaktsiyasi - alkinlarning hidratsiyasi. Majburiy agent simob tuzlari hisoblanadi. Aldegidlar va ketonlarni sintez qilishning sanoat usullaridan biri. R≡R-R + Hg 2+ + H 2 O = R-R-COH.
- Digalogenlangan uglevodorodlarning gidrolizi.
- Qaytarilishi: karboksilik kislotalar, amidlar, nitrillar, kislota xloridlari, efirlar. Natijada aldegid ham, keton ham hosil bo'ladi.
- Karboksilik kislotalar aralashmalarining katalizatorlar ustidan metall oksidi holida pirolizlanishi. Aralash bug'langan bo'lishi kerak. Uning mohiyati karbonat angidrid va suv molekulalari o'rtasidagi bo'linishdir. Natijada aldegid yoki keton hosil bo'ladi.
Aromatik aldegidlar va ketonlar boshqa usullar bilan tayyorlanadi, chunki bu birikmalar aromatik radikalga ega (masalan, fenil).
- Friedel-Craftsga ko'ra: boshlang'ich reagentlar aromatik uglevodorod va digalogenli ketonni o'z ichiga oladi. Katalizator - ALCL 3. Natijada aromatik aldegid yoki keton hosil bo'ladi. Jarayonning yana bir nomi - asilatsiya.
- Toluolning turli xil moddalar ta'sirida oksidlanishi.
- Aromatik karboksilik kislotalarning kamayishi.
Tabiiyki, sanoat xom ashyo imkon qadar arzon va katalizatorlar kamroq zaharli bo'lgan usullardan foydalanishga harakat qiladi. Aldegidlarning sintezi uchun bu alkenlarning kislorod bilan oksidlanishi.

Sanoatda qo'llanilishi va ahamiyati
Aldegidlar va ketonlardan foydalanish quyidagi sohalarda amalga oshiriladi:
- farmatsevtika;
- kimyoviy sintez;
- dori;
- parfyumeriya maydoni;
- Oziq-ovqat sanoati;
- bo'yoq va lak ishlab chiqarish;
- plastmassalar, matolar va boshqalar sintezi.
Bir nechta maydonlarni aniqlash mumkin, chunki har yili taxminan 6 million tonna formaldegid sintezlanadi! Uning 40% li eritmasi formalin deb ataladi va anatomik narsalarni saqlash uchun ishlatiladi. Bundan tashqari, dori-darmonlar, antiseptiklar va polimerlar ishlab chiqarish uchun ishlatiladi.
Asetaldegid yoki etanal ham ommaviy ishlab chiqariladigan mahsulotdir. Dunyoda yillik iste'mol miqdori taxminan 4 million tonnani tashkil etadi, bu muhim mahsulotlar hosil bo'lgan ko'plab kimyoviy sintezlarning asosidir. Masalan:
- sirka kislotasi va uning angidridi;
- tsellyuloza asetat;
- dorilar;
- butadien - kauchukning asosi;
- asetat tolasi.
Aromatik aldegidlar va ketonlar oziq-ovqat va parfyumeriya kabi ko'plab xushbo'y moddalarning tarkibiy qismidir. Ularning aksariyati juda yoqimli gul, sitrus, o'simlik aromalariga ega. Bu ular asosida ishlab chiqarish imkonini beradi:
- har xil turdagi havo spreyi;
- hojatxona va parfyumeriya suvlari;
- turli xil tozalash vositalari va yuvish vositalari.
Ulardan ba'zilari iste'mol qilish uchun tasdiqlangan aromatik oziq-ovqat qo'shimchalaridir. Ularning efir moylari, mevalar va qatronlardagi tabiiy tarkibi bunday foydalanish imkoniyatini isbotlaydi.
Shaxsiy vakillar
Sitral kabi aldegid yuqori viskoziteli va kuchli limon aromasiga ega suyuqlikdir. U tabiatda ikkinchisining efir moylarida uchraydi. Bundan tashqari, evkalipt, jo'xori, kabob mavjud.
Uning qo'llanilish sohalari yaxshi ma'lum:
- pediatriya - intrakranial bosimning pasayishi;
- kattalardagi qon bosimini normallashtirish;
- ko'rish organlari uchun dori komponenti;
- ko'plab xushbo'y moddalarning ajralmas qismi;
- yallig'lanishga qarshi va antiseptik;
- retinol sintezi uchun xom ashyo;
- oziq-ovqat maqsadlari uchun lazzatlanish.





















 Orqaga oldinga
Orqaga oldinga
Diqqat! Slaydni oldindan ko'rish faqat ma'lumot olish uchun mo'ljallangan va taqdimotning barcha xususiyatlarini aks ettirmasligi mumkin. Agar siz ushbu ish bilan qiziqsangiz, to'liq versiyasini yuklab oling.
Darsning maqsadi: aldegidlarning tarkibi, tuzilishi, tasnifi, fizik-kimyoviy xossalari, olinishi va ishlatilishini xarakterlaydi. Organik birikmalarning o'rganilayotgan sinflari o'rtasidagi munosabatni o'rnating. Aldegidlarga sifatli reaksiyalarni bilish.
Hayotimizning hamma joyida biz organik kimyoga duch kelamiz: biz kimyo sanoati mahsulotlarini iste'mol qilamiz, to'g'ridan-to'g'ri uning natijalariga ko'ra kiyinamiz: atsetat ipak, sun'iy jun, charm mahsulotlari va boshqalar, kimyo tufayli biz murakkab operatsiyalarni (behushlik), yaralarni davolashimiz mumkin. tomoqqa va faqat in'ektsiyalarni beramiz, bu erda biz antiseptik sifatida etil spirtini tanlaymiz.
Bugun biz sizni organik moddalar sinfi - aldegidlar bilan tanishtiramiz. Bugun darsimizda aldegidlarsiz hayot mumkin emasligini isbotlaymiz. Keling, ushbu mavzuga qanchalik ma'lum bo'lgan moddalar bilan bog'liqligini bilib olaylik: vanilin, yuvish vositalari, formaldegid, plastmassa, oyna, sirka kislotasi
Shunday qilib, aldegidlar molekulalarida qutbli karbonil guruhini o'z ichiga olgan organik birikmalardir. Okso guruhi bilan bog'liq bo'lgan o'rinbosarlarga qarab, bu moddalar aldegidlar va ketonlarga bo'linadi. Aldegidlarda karbonil guruhi uglevodorod radikali va vodorod atomi bilan, ketonlarda esa karbonil uglerod ikkita uglevodorod radikali bilan bog'langan.

To'yingan karbonil birikmalarining umumiy formulasi C n H 2n O
Trivial nomenklatura bo'yicha aldegidlarning nomlari ko'pincha tegishli monokarboksilik kislotalarning nomlaridan kelib chiqadi. Ratsional nomenklaturaga ko'ra, shoxlangan uglevodorod zanjiri aldegidlari atsetaldegidning hosilalari hisoblanadi. Tizimli nomenklaturaga ko'ra, ko'rib chiqilayotgan birikmalarning nomlari tegishli alkanlardan - al qo'shimchasi qo'shilishi bilan olingan.
Aldegidlarni olish usullari. Aldegidlarni olishning asosiy usullari spirtlarni katalitik dehidratsiyalash, alkinlarni hidratsiyalash va spirtlarni oksidlashdir.
Jismoniy xususiyatlar.
NSO to'yingan aldegidlarning gomologik qatorining birinchi a'zosi rangsiz gaz, keyingi bir qancha aldegidlar esa suyuqlikdir. Yuqori aldegidlar qattiq moddalardir. Karbonil guruhi aldegidlarning yuqori reaktivligini keltirib chiqaradi. Aldegidlarning qaynash harorati molekulyar og'irlik ortishi bilan ortadi. Ular mos keladigan spirtlarga qaraganda pastroq haroratda, masalan, propionaldegid 48,8 0 S, propil spirti 97,8 0 S da qaynatiladi.
Aldegidlarning zichligi birlikdan kichikdir. Formik va atsetaldegidlar suvda yaxshi eriydi, keyingilari esa kamroq eriydi. Pastki aldegidlar o'tkir, yoqimsiz hidga ega, ba'zi yuqori aldegidlar esa yoqimli hidga ega.
Aldegidlarning reaktivligi faol karbonil guruhining mavjudligi bilan bog'liq. Kislorod atomining yuqori elektromanfiyligi karbonil guruhidagi qo'sh bog'lanishning kuchli qutblanishiga va harakatlanuvchi a-elektronlarning kislorod atomi tomon siljishiga yordam beradi.

Aldegidlarning kimyoviy xossalari:
1. Qo‘shish reaksiyalari:
A) gidrogenlanish reaksiyasi
B) NaHSO 3 qo'shilish reaksiyasi
2. Oksidlanish reaksiyalari:
A) kumush oyna reaksiyasi
B) svetoforning reaksiyasi
3. Polikondensatlanish reaksiyasi
4. Polimerlanish reaksiyasi
Karboksil guruhiga sifatli reaksiya - aldegidlarning mis (II) gidroksid bilan oksidlanish reaktsiyasi - svetofor.
NSO + 2Cu(OH) 2 = HCOOH +Cu 2 O +2H 2 O
"Kumush oyna reaktsiyasi"
Hayotni oynasiz tasavvur qila olasizmi? Ertalab uyg'onib, o'z aksini ko'rmayapsizmi? Bu bema'nilik, arzimas narsaga o'xshaydi. Ammo qanday ruhiy noqulaylik! Bejizga ertak qahramonlari jazo sifatida aks etishdan mahrum bo'lishmagan. Oyna nima? Uning kuchi nimada? Qayerdan kelgan? U qanday yaratilgan?
Biz allaqachon bilganimizdek, birinchi haqiqiy nometall mis, oltin va kumushdan yasalgan, porlashi uchun sayqallangan metall plitalar edi. Biroq, bunday nometalllarning katta kamchiliklari bor edi - ular tezda qorong'ilashdi va havoda xiralashdi. Ushbu vaziyatdan chiqishning qanday yo'lini topdingiz? Ko'plab tajribalar shuni ko'rsatdiki, shishaga porloq metall qatlam ham qo'llanilishi mumkin. Shunday qilib, 1-asrda. AD shisha nometall - qo'rg'oshin yoki qalay plitalarga ulangan shisha plitalar ishlab chiqarila boshlandi. Bu shunday qilindi: ular stakanni spirt bilan yuvdilar, talk kukuni bilan tozaladilar, so'ngra qalay varaqni yuzaga mahkam bosdilar. Ustiga simob quyib, o‘tirib qo‘ygandan so‘ng, ortiqchasi to‘kilgan. Olingan amalgam qatlami muhrlangan yoki bo'yalgan. Bunday nometall metallga qaraganda ancha bardoshli bo'lib chiqdi, shuning uchun hunarmandchilik ustaxonalari aks ettiruvchi yuzasi qalay amalgamdan (simob Hg dagi qalay Sn eritmasi) qilingan shisha nometall ishlab chiqarishga o'tdi. Ammo, simob bug'i juda zaharli bo'lganligi sababli, simob oynalarini ishlab chiqarish juda zararli edi va ko'zgularning o'zida simob bor edi. Yashash joylarida simob oynalarini saqlash xavfli edi.
Shuning uchun olimlar simob o'rnini izlashda davom etdilar. Uni fransuz kimyogari Fransua Ptizan va buyuk nemis olimi Yustus Libig kashf etgan. Liebig kumush qoplamali shisha oyna yasashni taklif qildi. U ishlab chiqqan usul quyidagi operatsiyalardan iborat edi. Birinchidan, kumush nitrat AgNO 3 ning suvli eritmasiga kaliy gidroksidi KOH ning suvli eritmasi qo'shildi, bu kumush oksidi Ag 2 O ning qora-jigarrang cho'kmasining cho'kishiga olib keldi.
2AgNO3 + 2KOH = Ag2O + 2KNO3 + H2O.
Cho'kma filtrlanadi va ammiak NH 3 ning suvli eritmasi bilan aralashtiriladi.
Ag 2 O + 4NH 3 + H 2 O = 2 (OH).)
Kumush oksid ammiakli suvda eritilib, murakkab birikma (ammiak oksidi yoki amin) - diamin kumush (I) gidroksid hosil bo'ldi. Keyin yuzalaridan biri yaxshilab yog'sizlangan shisha varag'i hosil bo'lgan shaffof eritmaga botiriladi va formaldegid HCHO qo'shiladi.
2(OH) + HCHO = 2Ag + HCOONH4 + 3NH3 + H2O.)
Formaldegid shishaning tozalangan yuzasiga yotqizilgan kumushni kamaytirdi va uni porloq, oynaga o'xshash qoplama bilan qopladi.
Aldegidlar va ketonlarni qo'llash.
Formaldegid. To'yingan aldegidlarning gomologik seriyasining birinchi a'zosi formaldegid HCOH hisoblanadi. Men uni metanal va formik aldegid deb ham atayman. Bu o'ziga xos o'tkir hidli rangsiz gaz. Massa ulushlarida 0,4 yoki 40% metanalni o'z ichiga olgan suvli eritma keng qo'llaniladi. U formaldegid deb ataladi. Formaldegid (formalin), o'ziga xos o'tkir hidli shaffof, rangsiz suyuqlik. Qo'llarni yuvish, ortiqcha terlash paytida terini yuvish (0,5-1%), asboblarni dezinfektsiyalash (0,5%), yuvish uchun (1: 2000-1: 3000) dezinfektsiyalovchi va hidsizlantiruvchi vosita sifatida ishlatiladi. Lizoformning bir qismi.
Uning ishlatilishi, shuningdek, oqsillarni katlama qobiliyatiga asoslanadi. Masalan, teri ishlab chiqarishda formalinning ko'nchilik ta'siri oqsilning koagulyatsiyasi bilan izohlanadi, buning natijasida teri qotib qoladi va chirimaydi. Biologik preparatlarni saqlash uchun formaldegiddan foydalanish xuddi shu xususiyatga asoslanadi. Formaldegid ba'zan urug'larni dezinfektsiyalash va davolash uchun ishlatiladi. Metanal ba'zi dorivor moddalar va bo'yoqlarni ishlab chiqarishda ishlatiladi. Fenol-formaldegid qatronini ishlab chiqarish uchun ko'p miqdorda metanal ishlatiladi, bu metanalni fenol bilan reaksiyaga kiritish orqali olinadi. Ushbu qatron turli xil plastmassalarni ishlab chiqarish uchun zarurdir.

Fenol-formaldegid smolasidan turli plomba moddalar bilan birlashtirilgan plastmassalar fenollar deyiladi. Fenol-formaldegid smolalarini aseton yoki spirtda eritib, turli laklar olinadi.
Metanal karbamid CO(NH) 2 bilan oʻzaro taʼsirlashganda karbamid smolasi olinadi va undan aminoplastlar hosil boʻladi. Ushbu plastmassalardan elektrotexnika uchun mikrog'ovak materiallar (kalitlar, rozetkalar), mebel va ichki bezatish uchun materiallar, zarrachalar taxtalari va sun'iy marmar ishlab chiqariladi. Issiqlik va ovoz o'tkazmaydigan gözenekli materiallar.
Asetaldegid CH 3 - SON o'tkir bo'g'uvchi hidli rangsiz suyuqlikdir. Tsellyuloza asetatlar, sirka va peroksiasetik kislotalar, sirka angidrid, etil asetat, glyoksal, alkilaminlar, butanol, xloral ishlab chiqarishda ishlatiladi. Formaldegid singari, u aminlar, fenol va boshqa moddalar bilan polikondensatsiya reaktsiyalariga kiradi va sanoatda keng qo'llaniladigan sintetik qatronlar hosil qiladi.
Benzaldegid C 6 H 5 C (H) = O achchiq bodom hidi bilan bodom yog'ida va evkalipt efir moyida uchraydi. Sintetik benzaldegid oziq-ovqat aromati esensiyalari va parfyumeriya kompozitsiyalarida qo'llaniladi.
Alifatik aldegid CH 3 (CH 2) 7 C (H) = O (arzimas nomi pelargonaldegid) sitrus o'simliklarining efir moylarida uchraydi, apelsin hidiga ega va oziq-ovqat aromati sifatida ishlatiladi.
Aromatik aldegid vanillin tropik vanil o'simlikining mevalarida topilgan, endi sintetik vanillin ko'proq ishlatiladi - qandolat mahsulotlarida keng tarqalgan xushbo'y qo'shimcha.
Citral C 10 H 15 O (3,7-dimetil - 2,6-oktadienal) limon hidi bilan maishiy kimyoda qo'llaniladi.
Krotonaldegid. Butanol, sorbin va butirik kislotalarni ishlab chiqarish uchun ishlatiladigan kuchli lakrimator. Soya yog'ida mavjud. Aldegidlarning tibbiyotda qo‘llanilishi.
Cinnamaldegid dolchin yog'ida mavjud va doljin daraxtining qobig'ini distillash orqali olinadi. Tayoq yoki kukun shaklida pishirishda ishlatiladi
Geksatropin (CH 2) 6 N 4 (geksametilentetramin), rangsiz, hidsiz kristallar, suvda oson eriydi. Suvli eritmalar ishqoriy reaksiyaga ega. Antiseptik ta'sirga ega. Asosan siydik yo'llarining yuqumli jarayonlari (sistit, pyelit) uchun ishlatiladi. Ta'sir preparatning formaldegid hosil bo'lishi bilan kislotali muhitda parchalanish qobiliyatiga asoslangan. Preparat och qoringa buyuriladi. Uni qo'llash uchun ko'rsatmalar xoletsistit, xolangit, teri va ko'zning allergik kasalliklari (keratit, iridotsiklit va boshqalar). Preparat buyrak parenximasining tirnash xususiyati keltirib chiqarishi mumkin, agar bu belgilar paydo bo'lsa, preparatni qo'llashni to'xtatish kerak.
Akrolein. Juda qattiq plastmassa ishlab chiqarish uchun ishlatiladi. Akrolein va uning natriy tuzlari tuproqlarni tuzuvchi emulsifikatorlar bo'lib, uning lakton hosilalari qog'oz va to'qimachilik xususiyatlarini yaxshilaydi.
Bilimlarni umumlashtirish va tizimlashtirish. Darsni yakunlash.
Shunday qilib, aldegidlar va ketonlarning turli xil o'zgarishlarda ishtirok etish qobiliyati ularning turli xil organik moddalar: spirtlar, karboksilik kislotalar va ularning angidridlari, dorilar (urotropin), polimer mahsulotlari (fenol-formaldegid smolalari, poliformaldegid) sintezi uchun boshlang'ich birikmalar sifatida asosiy ishlatilishini aniqladi. ), ishlab chiqarishda barcha turdagi xushbo'y moddalar (benzaldegid asosida) va bo'yoqlar.
Uy vazifasi.