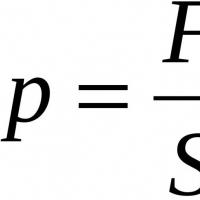Kimyoviy formula. Issiqlik va dpa uchun kimyo tayyorlash keng qamrovli nashri Azotga kirish. Ominlar
chiqindi miqdorini, yarim tayyor mahsulotlarning hosilini, yalpi og'irligini, sof og'irligini, tayyor mahsulot massasini hisoblash.
1. Mexanik pazandachilikni qayta ishlash jarayonida chiqindilar miqdorini hisoblash
(M otkh.):
M otkh.=M b*O/100, bu yerda
M chiqindilari - mexanik pazandalik qayta ishlash jarayonida chiqindilar massasi, g (kg);
M b – yalpi massa, g (kg);
2. Yarim tayyor mahsulotlarning hosildorligini hisoblash (Mp/f):
M p/f=M b*B p/f/100, bu yerda
M p/f - yarim tayyor mahsulotning og'irligi, g (kg);
M b - brutto og'irlik, g (kg)
Yarim tayyor mahsulotda – yarim tayyor mahsulot unumi, %
3. Yalpi massani hisoblash (M b):
M b=M n *100/(100-O), bu yerda
M b – yalpi massa, g (kg);
M n – sof vazn, g (kg);
O – mexanik pazandachilikni qayta ishlash chiqindilari, %
4. Sof massani hisoblash (M n):
M n = M b*(100-O)/100, bu yerda
M n – sof vazn, g (kg);
M b – yalpi massa, g (kg);
O – mexanik pazandachilikni qayta ishlash chiqindilari, %
5. Tayyor mahsulot massasini hisoblash (M tayyor):
M tayyor = M n * (100-P t.o.)/100, bu erda
M n – sof vazn, g (kg);
M n=M tayyor*100/(100-P shunday), bu yerda
M n – sof vazn, g (kg);
M goth. – tayyor mahsulot massasi, g (kg);
P t.o. – issiqlik bilan ishlov berishdagi yo‘qotishlar, %
6. Pazandachilik mahsulotlarining ozuqaviy va energiya qiymatini hisoblash formulalari:
6.1 Mahsulot tarkibidagi ozuqa moddalari (K):
K=M N *TO spr /100, qaerda
MN – retsept bo'yicha mahsulotning sof massasi, g;
6.2 Issiqlik bilan ishlov berishdan keyin oziq-ovqat moddasining miqdori (P):
P=SK*P spr /100, qaerda
P - issiqlik bilan ishlov berishdan keyin oziq-ovqat moddasining miqdori (g, mg, mkg);
SK – idishdagi kerakli ozuqaning umumiy miqdori (g, mg, mkg);
P spr - ma'lumotnomaga muvofiq idishdagi oziq-ovqat moddalarining saqlanishi, %.
6.3 P spr = 100 - P p.v. (%), qayerda
P p.v. - issiqlik bilan ishlov berish natijasida oziq-ovqat moddalarining yo'qolishi (ma'lumotnoma bo'yicha), %.
3-ilova
TEXNOLOGIK XARITALARNI ISHLAB CHIQISH
Umumiy ovqatlanish mahsulotlarining texnologik xaritasi - taomlar, pazandalik mahsulotlari, non va unli qandolat mahsulotlari retseptlari to'plami yoki texnik va texnologik xarita asosida tuzilgan texnik hujjat. Texnologik xaritada korxona nomi, retsept manbasi (Retseptlar to'plami, nashr etilgan yili, retseptning raqami va versiyasi yoki muallifning familiyasi, ismi, otasining ismi, yili va raqami) ko'rsatilgan. texnik va texnologik xaritasi).
Retseptni tavsiflashda 1 porsiyaga (1000 g uchun) grammdagi mahsulotlarning iste'mol darajasi va ma'lum bir korxonada ishlab chiqarilgan mahsulotlarning eng ko'p takrorlanadigan partiyalari uchun kg ko'rsatilgan. Retseptlar tuz, ziravorlar, o'tlar va boshqa mahsulotlarning miqdorini ko'rsatadi, ular to'plamlarda odatda matnda yoki 28-jadvalda ko'rsatilgan "Idishlar va mahsulotlarni tayyorlashda tuz va ziravorlar iste'moli".
Idish, pazandalik yoki qandolatchilik mahsulotlarini tayyorlash texnologiyasi ishlatiladigan asbob-uskunalar va inventarlarni ko'rsatgan holda ketma-ket tavsiflanadi. Texnologiyani tavsiflashda texnologik jarayonning parametrlarini ko'rsating: issiqlik bilan ishlov berish muddati (min), harorat (°C) va boshqalar; ovqatni taqdim etish va berish tartibi. Organoleptik sifat ko'rsatkichlari beriladi: tashqi ko'rinishi, konsistensiyasi, rangi, ta'mi va hidi.
Umumiy ovqatlanish xizmatlarini ko'rsatish qoidalariga muvofiq, oshpazlik mahsulotlarini ishlab chiqaruvchi iste'molchilarni idishlar, pazandalik, un va qandolat mahsulotlarining ozuqaviy va energiya qiymati to'g'risida xabardor qilishi shart. Shuning uchun texnologik xaritada idishning (mahsulotning) ozuqaviy va energiya qiymati haqida ma'lumot berish tavsiya etiladi.
Ilova (A2) namunaviy texnologik xaritani taqdim etadi.
Xo'sh, spirtli ichimliklar bilan tanishishimizni yakunlash uchun men boshqa taniqli moddaning formulasini ham beraman - xolesterin. Bu monohidrik spirt ekanligini hamma ham bilmaydi!
|`/`\\`|<`|w>`\`/|<`/w$color(red)HO$color()>\/`|0/`|/\<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`\|dH; #a_(A-72)<_(A-120,d+)>-/-/<->`\
Undagi gidroksil guruhini qizil rang bilan belgiladim.
Karboksilik kislotalar
Har qanday vino ishlab chiqaruvchi sharobni havoga kirmasdan saqlash kerakligini biladi. Aks holda u nordon bo'ladi. Ammo kimyogarlar sababini bilishadi - agar siz spirtga boshqa kislorod atomini qo'shsangiz, siz kislota olasiz.Keling, bizga allaqachon tanish bo'lgan spirtlardan olingan kislotalarning formulalarini ko'rib chiqaylik:
| Modda | Skelet formulasi | Yalpi formula | ||
|---|---|---|---|---|
| Metan kislotasi (chumoli kislotasi) |
H/C`|O|\OH | HCOOH | O//\OH | |
| Etan kislotasi (sirka kislotasi) |
H-C-C\O-H; H|#C|H | CH3-COOH | /`|O|\OH | |
| Propan kislotasi (metil sirka kislotasi) |
H-C-C-C\O-H; H|#2|H; H|#3|H | CH3-CH2-COOH | \/`|O|\OH | |
| Butan kislotasi (butirik kislota) |
H-C-C-C-C\O-H; H|#2|H; H|#3|H; H|#4|H | CH3-CH2-CH2-COOH | /\/`|O|\OH | |
| Umumiy formula | (R) -C\O-H | (R)-COOH yoki (R)-CO2H | (R)/`|O|\OH |
Organik kislotalarning o'ziga xos xususiyati - bunday moddalarga kislotali xususiyatlarni beruvchi karboksil guruhi (COOH) mavjudligi.
Sirkani sinab ko'rgan har bir kishi uning juda nordon ekanligini biladi. Buning sababi - unda sirka kislotasi mavjudligi. Odatda stol sirkasi tarkibida 3 dan 15% gacha sirka kislotasi, qolgan qismi (asosan) suv mavjud. Sirka kislotasini suyultirilmagan holda iste'mol qilish hayot uchun xavf tug'diradi.
Karboksilik kislotalar bir nechta karboksil guruhlarga ega bo'lishi mumkin. Bunday holda, ular chaqiriladi: ikki asosli, qabilaviy va hokazo...
Oziq-ovqat mahsulotlarida boshqa ko'plab organik kislotalar mavjud. Mana ulardan bir nechtasi:
Ushbu kislotalarning nomi ular tarkibidagi oziq-ovqat mahsulotlariga mos keladi. Aytgancha, iltimos, bu erda spirtli ichimliklarga xos bo'lgan gidroksil guruhiga ega kislotalar mavjudligini unutmang. Bunday moddalar deyiladi gidroksikarboksilik kislotalar(yoki gidroksi kislotalar).
Quyida, har bir kislota ostida, u tegishli bo'lgan organik moddalar guruhining nomini ko'rsatadigan belgi mavjud.
Radikallar
Radikallar kimyoviy formulalarga ta'sir qilgan yana bir tushunchadir. Bu so'zning o'zi, ehtimol, hammaga ma'lum, ammo kimyoda radikallar siyosatchilar, isyonchilar va faol pozitsiyaga ega bo'lgan boshqa fuqarolar bilan hech qanday umumiylik yo'q.
Bu erda bu faqat molekulalarning bo'laklari. Va endi biz ularni nima o'ziga xosligini aniqlaymiz va kimyoviy formulalarni yozishning yangi usuli bilan tanishamiz.
Umumlashtirilgan formulalar allaqachon matnda bir necha bor eslatib o'tilgan: spirtlar - (R) - OH va karboksilik kislotalar - (R) - COOH. Eslatib o'taman -OH va -COOH funktsional guruhlardir. Ammo R radikaldir. U R harfi sifatida tasvirlangani bejiz emas.
Aniqroq qilib aytadigan bo'lsak, monovalent radikal molekulaning bitta vodorod atomiga ega bo'lmagan qismidir. Xo'sh, agar siz ikkita vodorod atomini ayirsangiz, ikki valentli radikal olasiz.
Kimyodagi radikallar o'z nomlarini oldilar. Ulardan ba'zilari hatto elementlarning belgilariga o'xshash lotincha belgilarni ham oldilar. Bundan tashqari, ba'zida formulalarda radikallar yalpi formulalarni eslatuvchi qisqartirilgan shaklda ko'rsatilishi mumkin.
Bularning barchasi quyidagi jadvalda ko'rsatilgan.
| Ism | Strukturaviy formula | Belgilanish | Qisqacha formula | Spirtli ichimliklarga misol | ||
|---|---|---|---|---|---|---|
| Metil | CH3-() | Men | CH3 | (Men) - OH | CH3OH | |
| Etil | CH3-CH2-() | Et | C2H5 | (Et) -OH | C2H5OH | |
| kesib tashladim | CH3-CH2-CH2-() | Pr | C3H7 | (Pr) -OH | C3H7OH | |
| Izopropil | H3C\CH(*`/H3C*)-() | i-Pr | C3H7 | (i-Pr) -OH | (CH3)2CHOH | |
| fenil | `/`=`\//-\\-{} | Ph | C6H5 | (Ph) -OH | C6H5OH | |
Menimcha, bu erda hamma narsa aniq. Men sizning e'tiboringizni faqat spirtli ichimliklar misollari keltirilgan ustunga qaratmoqchiman. Ba'zi radikallar yalpi formulaga o'xshash shaklda yoziladi, lekin funktsional guruh alohida yoziladi. Masalan, CH3-CH2-OH C2H5OH ga aylanadi.
Va izopropil kabi tarvaqaylab ketgan zanjirlar uchun qavsli tuzilmalar qo'llaniladi.
Kabi hodisa ham mavjud erkin radikallar. Bular, ba'zi sabablarga ko'ra, funktsional guruhlardan ajralib chiqqan radikallardir. Bunday holda, biz formulalarni o'rganishni boshlagan qoidalardan biri buziladi: kimyoviy bog'lanishlar soni endi atomlardan birining valentligiga to'g'ri kelmaydi. Xo'sh, yoki biz ulanishlardan biri bir uchida ochiq bo'ladi, deb aytishimiz mumkin. Erkin radikallar odatda qisqa vaqt yashaydi, chunki molekulalar barqaror holatga qaytadi.
Azot bilan tanishtirish. Ominlar
Men ko'plab organik birikmalarning bir qismi bo'lgan boshqa element bilan tanishishni taklif qilaman. Bu azot.
Lotin harfi bilan belgilanadi N va uch valentlikka ega.
Keling, tanish uglevodorodlarga azot qo'shilsa, qanday moddalar olinishini ko'rib chiqaylik:
| Modda | Kengaytirilgan strukturaviy formula | Soddalashtirilgan strukturaviy formula | Skelet formulasi | Yalpi formula |
|---|---|---|---|---|
| Aminometan (metilamin) |
H-C-N\H;H|#C|H | CH3-NH2 | \NH2 | |
| Aminoetan (etilamin) |
H-C-C-N\H;H|#C|H;H|#3|H | CH3-CH2-NH2 | /\NH2 | |
| Dimetilamin | H-C-N<`|H>-C-H; H|#-3|H; H|#2|H | $L(1,3)H/N<_(A80,w+)CH3>\dCH3 | /N<_(y-.5)H>\ | |
| Aminobenzol (Anilin) |
H\N|C\\C|C<\H>`//C<|H>`\C<`/H>`||C<`\H>/ | NH2|C\\CH|CH`//C<_(y.5)H>`\HC`||HC/ | NH2|\|`/`\`|/_o | |
| Trietilamin | $qiyalik (45)H-C-C/N\C-C-H;H|#2|H; H|#3|H; H|#5|H;H|#6|H; #N`|C<`-H><-H>`|C<`-H><-H>`|H | CH3-CH2-N<`|CH2-CH3>-CH2-CH3 | \/N<`|/>\| |
Nomlardan allaqachon taxmin qilganingizdek, bu moddalarning barchasi umumiy nom ostida birlashtirilgan aminlar. Funktsional guruh ()-NH2 deyiladi amino guruhi. Quyida aminlarning umumiy formulalari keltirilgan:
Umuman olganda, bu erda hech qanday maxsus yangiliklar yo'q. Agar ushbu formulalar sizga tushunarli bo'lsa, unda siz darslik yoki Internetdan foydalangan holda organik kimyoni qo'shimcha o'rganish bilan shug'ullanishingiz mumkin.
Lekin noorganik kimyodagi formulalar haqida ham gapirmoqchiman. Organik molekulalarning tuzilishini o'rganganingizdan so'ng ularni tushunish qanchalik oson ekanligini ko'rasiz.
Ratsional formulalar
Noorganik kimyo organik kimyoga qaraganda osonroq degan xulosaga kelmaslik kerak. Albatta, noorganik molekulalar ancha sodda ko'rinishga ega, chunki ular uglevodorodlar kabi murakkab tuzilmalarni hosil qilmaydi. Ammo keyin biz davriy jadvalni tashkil etuvchi yuzdan ortiq elementlarni o'rganishimiz kerak. Va bu elementlar kimyoviy xossalariga ko'ra birlashishga moyildirlar, lekin ko'p istisnolardan tashqari.
Shunday qilib, men sizga bularning hech birini aytmayman. Mening maqolamning mavzusi kimyoviy formulalar. Va ular bilan hamma narsa nisbatan sodda.
Ko'pincha noorganik kimyoda qo'llaniladi ratsional formulalar. Va endi biz ular bizga tanish bo'lganlardan qanday farq qilishini aniqlaymiz.
Birinchidan, yana bir element - kaltsiy bilan tanishamiz. Bu ham juda keng tarqalgan element.
Belgilangan Ca va ikki valentlikka ega. Keling, biz bilgan uglerod, kislorod va vodorod bilan qanday birikmalar hosil qilishini ko'rib chiqaylik.
| Modda | Strukturaviy formula | Ratsional formula | Yalpi formula |
|---|---|---|---|
| Kaltsiy oksidi | Ca=O | CaO | |
| Kaltsiy gidroksidi | H-O-Ca-O-H | Ca(OH)2 | |
| Kaltsiy karbonat | $slope(45)Ca`/O\C|O`|/O`\#1 | CaCO3 | |
| Kaltsiy bikarbonat | HO/`|O|\O/Ca\O/`|O|\OH | Ca(HCO3)2 | |
| Karbon kislotasi | H|O\C|O`|/O`|H | H2CO3 |
Bir qarashda siz ratsional formulani strukturaviy va yalpi formula o'rtasidagi narsa ekanligini ko'rishingiz mumkin. Ammo ular qanday qilib olinganligi hali aniq emas. Ushbu formulalarning ma'nosini tushunish uchun siz moddalar ishtirok etadigan kimyoviy reaktsiyalarni hisobga olishingiz kerak.
Kaltsiy sof shaklda yumshoq oq metalldir. Bu tabiatda uchramaydi. Ammo uni kimyo do'konida sotib olish juda mumkin. Odatda havo kirishi mumkin bo'lmagan maxsus bankalarda saqlanadi. Chunki havoda u kislorod bilan reaksiyaga kirishadi. Aslida, shuning uchun u tabiatda uchramaydi.
Shunday qilib, kaltsiyning kislorod bilan reaktsiyasi:
2Ca + O2 -> 2CaO
Moddaning formulasidan oldingi 2 raqami reaksiyada 2 ta molekula ishtirok etishini bildiradi.
Kaltsiy va kislorod kaltsiy oksidini hosil qiladi. Bu modda tabiatda ham uchramaydi, chunki u suv bilan reaksiyaga kirishadi:
CaO + H2O -> Ca(OH2)
Natijada kaltsiy gidroksid hosil bo'ladi. Agar siz uning strukturaviy formulasiga (oldingi jadvalda) diqqat bilan qarasangiz, u biz allaqachon tanish bo'lgan bitta kaltsiy atomi va ikkita gidroksil guruhidan tashkil topganligini ko'rishingiz mumkin.
Bular kimyo qonunlari: organik moddaga gidroksil guruhi qo'shilsa, spirt, metallga qo'shilsa, gidroksid olinadi.
Ammo kaltsiy gidroksidi havoda karbonat angidrid mavjudligi sababli tabiatda uchramaydi. Menimcha, bu gaz haqida hamma eshitgan. U odamlar va hayvonlarning nafas olishi, ko'mir va neft mahsulotlarining yonishi, yong'inlar va vulqon otilishi paytida hosil bo'ladi. Shuning uchun u doimo havoda mavjud. Ammo u suvda juda yaxshi eriydi va karbonat kislota hosil qiladi:
CO2 + H2O<=>H2CO3
Imzo<=>reaksiya bir xil sharoitda har ikki yo‘nalishda ham borishi mumkinligini ko‘rsatadi.
Shunday qilib, suvda erigan kaltsiy gidroksid karbonat kislotasi bilan reaksiyaga kirishadi va ozgina eriydigan kaltsiy karbonatiga aylanadi:
Ca(OH)2 + H2CO3 -> CaCO3"|v" + 2H2O
Pastga o'q, reaktsiya natijasida moddaning cho'kishi degan ma'noni anglatadi.
Suv ishtirokida kaltsiy karbonatning karbonat angidrid bilan keyingi aloqasi bilan kislotali tuz - suvda yaxshi eriydigan kaltsiy bikarbonat hosil bo'lishi uchun teskari reaktsiya sodir bo'ladi.
CaCO3 + CO2 + H2O<=>Ca(HCO3)2
Bu jarayon suvning qattiqligiga ta'sir qiladi. Harorat ko'tarilgach, bikarbonat yana karbonatga aylanadi. Shuning uchun, qattiq suvli hududlarda choynaklarda shkala hosil bo'ladi.
Bo'r, ohaktosh, marmar, tüf va boshqa ko'plab minerallar asosan kaltsiy karbonatdan iborat. Shuningdek, u marjonlar, mollyuskalar qobig'i, hayvonlar suyaklari va boshqalarda uchraydi ...
Ammo agar kaltsiy karbonat juda yuqori issiqlikda qizdirilsa, u kaltsiy oksidi va karbonat angidridga aylanadi.
Tabiatdagi kaltsiy aylanishi haqidagi bu qisqa hikoya ratsional formulalar nima uchun kerakligini tushuntirishi kerak. Shunday qilib, ratsional formulalar funktsional guruhlar ko'rinadigan tarzda yoziladi. Bizning holatlarimizda bu:
Bundan tashqari, alohida elementlar - Ca, H, O (oksidlarda) ham mustaqil guruhlardir.Ionlar
Menimcha, ionlar bilan tanishish vaqti keldi. Bu so'z, ehtimol, hammaga tanish. Funktsional guruhlarni o'rganib chiqqandan so'ng, bu ionlar nima ekanligini aniqlash uchun bizga hech narsa xarajat qilmaydi.
Umuman olganda, kimyoviy bog'lanishlarning tabiati odatda ba'zi elementlar elektronlardan voz kechsa, boshqalari esa ularni oladi. Elektronlar manfiy zaryadli zarralardir. To'liq elektron to'ldiruvchi element nol zaryadga ega. Agar u elektronni bergan bo'lsa, unda uning zaryadi ijobiy bo'ladi va agar u uni qabul qilsa, u salbiy bo'ladi. Masalan, vodorodda faqat bitta elektron mavjud bo'lib, u juda oson voz kechib, ijobiy ionga aylanadi. Buning uchun kimyoviy formulalarda maxsus yozuv mavjud:
H2O<=>H^+ + OH^-
Mana biz buni natija sifatida ko'ramiz elektrolitik dissotsiatsiya suv musbat zaryadlangan vodorod ioniga va manfiy zaryadlangan OH guruhiga parchalanadi. OH^- ioni deyiladi gidroksid ioni. Uni ion emas, balki qandaydir molekulaning bir qismi bo'lgan gidroksil guruhi bilan aralashtirib yubormaslik kerak. Yuqori o'ng burchakdagi + yoki - belgisi ionning zaryadini ko'rsatadi.
Ammo karbonat kislota hech qachon mustaqil modda sifatida mavjud emas. Aslida, bu vodorod ionlari va karbonat ionlari (yoki bikarbonat ionlari) aralashmasidir:
H2CO3 = H^+ + HCO3^-<=>2H^+ + CO3^2-
Karbonat ioni 2- zaryadga ega. Bu unga ikkita elektron qo'shilganligini anglatadi.
Manfiy zaryadlangan ionlar deyiladi anionlar. Odatda bu kislotali qoldiqlarni o'z ichiga oladi.
Ijobiy zaryadlangan ionlar - kationlar. Ko'pincha bu vodorod va metallardir.
Va bu erda siz ratsional formulalarning ma'nosini to'liq tushunishingiz mumkin. Ularda avval kation, keyin esa anion yoziladi. Formulada hech qanday to'lovlar bo'lmasa ham.
Ehtimol, siz ionlarni nafaqat ratsional formulalar bilan tavsiflash mumkinligini taxmin qilgansiz. Mana bikarbonat anionining skelet formulasi:
Bu erda zaryad to'g'ridan-to'g'ri kislorod atomining yonida ko'rsatilgan, u qo'shimcha elektron olgan va shuning uchun bitta chiziqni yo'qotgan. Oddiy qilib aytganda, har bir qo'shimcha elektron strukturaviy formulada tasvirlangan kimyoviy bog'lanishlar sonini kamaytiradi. Boshqa tomondan, agar strukturaviy formulaning ba'zi tugunlari + belgisiga ega bo'lsa, unda qo'shimcha tayoq mavjud. Har doimgidek, bu haqiqatni misol bilan ko'rsatish kerak. Ammo bizga tanish bo'lgan moddalar orasida bir nechta atomlardan iborat bitta kation yo'q.
Va bunday modda ammiakdir. Uning suvli eritmasi ko'pincha deyiladi nashatir spirti va har qanday birinchi yordam to'plamiga kiritilgan. Ammiak vodorod va azot birikmasidir va NH3 ratsional formulasiga ega. Ammiak suvda eritilganda sodir bo'ladigan kimyoviy reaktsiyani ko'rib chiqing:
NH3 + H2O<=>NH4^+ + OH^-
Xuddi shu narsa, lekin tizimli formulalar yordamida:
H|N<`/H>\H + H-O-H<=>H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
O'ng tomonda biz ikkita ionni ko'ramiz. Ular bitta vodorod atomining suv molekulasidan ammiak molekulasiga o'tishi natijasida hosil bo'lgan. Ammo bu atom elektronsiz harakat qildi. Anion bizga allaqachon tanish - bu gidroksid ionidir. Va kation deyiladi ammoniy. U metallarga o'xshash xususiyatlarni namoyish etadi. Misol uchun, u kislotali qoldiq bilan birlashishi mumkin. Ammoniyni karbonat anioni bilan birlashtirib hosil bo'lgan moddaga ammoniy karbonat deyiladi: (NH4)2CO3.
Ammoniyning karbonat anioni bilan o'zaro ta'sirining reaktsiya tenglamasi tuzilish formulalari shaklida yozilgan:
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-\C|O`|/O^-<=>H|N^+<`/H><_(A75,w+)H>_(A15,d+)H`|0O^-\C|O`|/O^-|0H_(A-15,d-)N^+<_(A105,w+)H><\H>`|H
Lekin bu shaklda reaksiya tenglamasi namoyish qilish uchun berilgan. Odatda tenglamalar ratsional formulalardan foydalanadi:
2NH4^+ + CO3^2-<=>(NH4)2CO3
Tepalik tizimi
Shunday qilib, biz allaqachon strukturaviy va ratsional formulalarni o'rganib chiqdik deb taxmin qilishimiz mumkin. Ammo batafsilroq ko'rib chiqishga arziydigan yana bir masala bor. Yalpi formulalar oqilona formulalardan qanday farq qiladi?
Biz karbonat kislotasining ratsional formulasi nima uchun H2CO3 deb yozilishini bilamiz, lekin boshqa yo'l bilan emas. (Birinchi navbatda ikkita vodorod kationi, keyin esa karbonat anioni keladi.) Lekin nima uchun yalpi formula CH2O3 deb yozilgan?
Aslida, uglerod kislotasining ratsional formulasini haqiqiy formula deb hisoblash mumkin, chunki unda takrorlanuvchi elementlar yo'q. NH4OH yoki Ca(OH)2 dan farqli o'laroq.
Ammo qo'shimcha qoida ko'pincha yalpi formulalarga qo'llaniladi, bu elementlarning tartibini belgilaydi. Qoida juda oddiy: birinchi navbatda uglerod, keyin vodorod, so'ngra qolgan elementlar alifbo tartibida joylashtiriladi.
Shunday qilib, CH2O3 chiqadi - uglerod, vodorod, kislorod. Bu tepalik tizimi deb ataladi. U deyarli barcha kimyoviy ma'lumotnomalarda qo'llaniladi. Va bu maqolada ham.
EasyChem tizimi haqida bir oz
Xulosa o'rniga men easyChem tizimi haqida gapirmoqchiman. U biz muhokama qilgan barcha formulalarni matnga osongina kiritish uchun yaratilgan. Aslida, ushbu maqoladagi barcha formulalar easyChem yordamida chizilgan.
Nega bizga formulalarni chiqarish uchun qandaydir tizim kerak? Gap shundaki, Internet-brauzerlarda ma'lumotni ko'rsatishning standart usuli - bu gipermatn belgilash tili (HTML). U matnli ma'lumotlarni qayta ishlashga qaratilgan.
Matn yordamida ratsional va yalpi formulalarni tasvirlash mumkin. Hatto ba'zi soddalashtirilgan strukturaviy formulalar ham matnda yozilishi mumkin, masalan, spirt CH3-CH2-OH. Buning uchun HTML-da quyidagi yozuvdan foydalanishingiz kerak bo'lsa-da: CH 3-CH 2-OH.
Bu, albatta, ba'zi qiyinchiliklarni keltirib chiqaradi, lekin siz ular bilan yashashingiz mumkin. Ammo strukturaviy formulani qanday tasvirlash kerak? Printsipial jihatdan siz monospace shriftidan foydalanishingiz mumkin:
H H | | H-C-C-O-H | | H H Albatta, bu juda yaxshi ko'rinmaydi, lekin bu ham mumkin.
Haqiqiy muammo benzol halqalarini chizishga urinayotganda va skelet formulalaridan foydalanganda paydo bo'ladi. Rastr tasvirini ulashdan boshqa yo'l qolmadi. Rastrlar alohida fayllarda saqlanadi. Brauzerlar gif, png yoki jpeg formatidagi rasmlarni o'z ichiga olishi mumkin.
Bunday fayllarni yaratish uchun grafik muharrir kerak bo'ladi. Masalan, Photoshop. Lekin men Photoshop bilan 10 yildan ortiq tanishman va aniq ayta olamanki, u kimyoviy formulalarni tasvirlash uchun juda mos emas.
Molekulyar muharrirlar bu vazifani ancha yaxshi bajaradilar. Ammo har biri alohida faylda saqlanadigan ko'p sonli formulalar bilan ularni chalkashtirib yuborish juda oson.
Masalan, ushbu maqoladagi formulalar soni . Ular grafik tasvirlar ko'rinishida ko'rsatiladi (qolganlari HTML vositalari yordamida).
EasyChem tizimi barcha formulalarni to'g'ridan-to'g'ri HTML hujjatida matn shaklida saqlash imkonini beradi. Menimcha, bu juda qulay.
Bundan tashqari, ushbu maqoladagi yalpi formulalar avtomatik ravishda hisoblanadi. Chunki easyChem ikki bosqichda ishlaydi: avval matn tavsifi axborot strukturasiga (grafik) aylantiriladi, so‘ngra bu tuzilmada turli amallarni bajarish mumkin. Ular orasida quyidagi funktsiyalarni ajratib ko'rsatish mumkin: molekulyar og'irlikni hisoblash, yalpi formulaga o'tkazish, matn, grafik va matn ko'rinishida chiqish imkoniyatini tekshirish.
Shunday qilib, ushbu maqolani tayyorlash uchun men faqat matn muharriridan foydalandim. Bundan tashqari, qaysi formula grafik va qaysi matn bo'lishi haqida o'ylashim shart emas edi.
Maqola matnini tayyorlash sirini ochib beradigan bir nechta misollar: Chap ustundagi tavsiflar avtomatik ravishda ikkinchi ustundagi formulalarga aylanadi.
Birinchi qatorda ratsional formulaning tavsifi ko'rsatilgan natijaga juda o'xshash. Faqatgina farq shundaki, raqamli koeffitsientlar interlinear tarzda ko'rsatiladi.
Ikkinchi qatorda kengaytirilgan formula belgi bilan ajratilgan uchta alohida zanjir shaklida berilgan; O'ylaymanki, matn tavsifi ko'p jihatdan formulani qog'ozda qalam bilan tasvirlash uchun zarur bo'lgan harakatlarni eslatadi.
Uchinchi qatorda \ va / belgilaridan foydalangan holda qiya chiziqlardan foydalanish ko'rsatilgan. ` (backtick) belgisi chiziq o'ngdan chapga (yoki pastdan yuqoriga) chizilganligini bildiradi.
Bu yerda easyChem tizimidan foydalanish bo‘yicha batafsilroq hujjatlar mavjud.
Keling, ushbu maqolani tugataman va kimyoni o'rganishda omad tilayman.
Maqolada foydalanilgan atamalarning qisqacha izohli lug'ati
Uglevodorodlar Uglerod va vodoroddan tashkil topgan moddalar. Ular molekulalarining tuzilishida bir-biridan farq qiladi. Strukturaviy formulalar molekulalarning sxematik tasvirlari bo'lib, atomlar lotin harflari bilan, kimyoviy bog'lanishlar esa tire bilan belgilanadi. Strukturaviy formulalar kengaytirilgan, soddalashtirilgan va skeletlari topilgan. Kengaytirilgan strukturaviy formulalar har bir atom alohida tugun sifatida ifodalangan strukturaviy formulalardir. Soddalashtirilgan struktura formulalari - vodorod atomlari ular bilan bog'langan element yonida yozilgan strukturaviy formulalar. Va agar bitta atomga bir nechta vodorod biriktirilgan bo'lsa, u holda miqdor raqam sifatida yoziladi. Guruhlar soddalashtirilgan formulalarda tugun vazifasini bajaradi, deb ham aytishimiz mumkin. Skelet formulalari - bu uglerod atomlari bo'sh tugunlar sifatida tasvirlangan strukturaviy formulalar. Har bir uglerod atomi bilan bog'langan vodorod atomlari soni 4 minus saytda birlashadigan aloqalar soniga teng. Uglerod bilan hosil bo'lmagan tugunlar uchun soddalashtirilgan formulalar qoidalari qo'llaniladi. Yalpi formula (haqiqiy formula sifatida ham tanilgan) - molekulani tashkil etuvchi barcha kimyoviy elementlarning ro'yxati, atomlar sonini raqam shaklida ko'rsatadi (agar bitta atom bo'lsa, unda birlik yozilmagan) tepalik tizimi - yalpi formula formulasida atomlarning tartibini belgilaydigan qoida: alifbo tartibida birinchi navbatda uglerod, keyin vodorod, so'ngra qolgan elementlar joylashtiriladi. Bu juda tez-tez ishlatiladigan tizim. Va ushbu maqoladagi barcha yalpi formulalar Hill tizimiga muvofiq yozilgan. Funktsional guruhlar Kimyoviy reaksiyalar jarayonida saqlanib qolgan atomlarning barqaror birikmalari. Ko'pincha funktsional guruhlar o'z nomlariga ega va moddaning kimyoviy xossalari va ilmiy nomiga ta'sir qiladi yuklab olingMavzusida insho:
Kimyoviy formula
Kimyoviy formula- moddalarning tarkibi va tuzilishi haqidagi ma'lumotlarni kimyoviy belgilar, raqamlar va bo'linish belgilari - qavslar yordamida aks ettirish.
Murakkab moddalar molekulalarining tarkibi kimyoviy formulalar yordamida ifodalanadi.
Kimyoviy formulaga asoslanib, moddaning nomi berilishi mumkin.
Kimyoviy formula quyidagilarni anglatadi:
- 1 molekula yoki 1 mol modda;
- sifat tarkibi (modda qanday kimyoviy elementlardan iborat);
- miqdoriy tarkibi (moddaning molekulasi har bir elementning nechta atomini o'z ichiga oladi).
- HNO3 formulasi quyidagilarni anglatadi:
- azot kislotasi;
- 1 molekula nitrat kislota yoki 1 mol nitrat kislota;
- sifat tarkibi: nitrat kislota molekulasi vodorod, azot va kisloroddan iborat;
- miqdoriy tarkibi: nitrat kislota molekulasida vodorod elementining bir atomi, azot elementining bir atomi, kislorod elementining uchta atomi mavjud.
Turlari
Hozirgi vaqtda kimyoviy formulalarning quyidagi turlari ajratiladi:
- Eng oddiy formula. Elementlarning atom massasi qiymatlaridan foydalangan holda moddadagi kimyoviy elementlarning nisbatini aniqlash orqali eksperimental ravishda olinishi mumkin. Shunday qilib, suvning eng oddiy formulasi H 2 O va benzol CH ning eng oddiy formulasi bo'ladi (C 6 H 6 dan farqli o'laroq - to'g'ri, pastga qarang). Formulalardagi atomlar kimyoviy elementlarning belgilari bilan, nisbiy miqdorlari esa pastki belgilar shaklida raqamlar bilan ko'rsatilgan.
- Haqiqiy formula. Agar moddaning molekulyar og'irligi ma'lum bo'lsa, olinishi mumkin. Suvning haqiqiy formulasi H 2 O bo'lib, u eng oddiy bilan mos keladi. Benzolning haqiqiy formulasi C 6 H 6 bo'lib, u eng oddiyidan farq qiladi. Haqiqiy formulalar yalpi formulalar yoki empirik formulalar deb ham ataladi. Ular moddaning molekulalarining tuzilishini emas, balki tarkibini aks ettiradi. Haqiqiy formula bitta molekuladagi har bir element atomlarining aniq sonini ko'rsatadi. Bu miqdor indeksga to'g'ri keladi - mos keladigan element belgisidan keyin kichik raqam. Agar indeks 1 bo'lsa, ya'ni molekulada berilgan elementning faqat bitta atomi bo'lsa, unda bunday indeks ko'rsatilmaydi.
- Ratsional formula. Ratsional formulalar kimyoviy birikmalar sinflariga xos bo'lgan atomlar guruhlarini ajratib ko'rsatadi. Masalan, spirtli ichimliklar uchun -OH guruhi ajratilgan. Ratsional formulani yozishda bunday atomlar guruhlari qavslar (OH) ichiga olinadi. Takrorlanuvchi guruhlar soni pastki ko'rinishdagi raqamlar bilan ko'rsatiladi, ular yopilish qavsdan keyin darhol joylashtiriladi. Kvadrat qavslar kompleks birikmalarning tuzilishini aks ettirish uchun ishlatiladi. Masalan, K 4 kaliy geksasianokobaltoatdir. Ratsional formulalar ko'pincha yarim kengaytirilgan shaklda, modda molekulasining tuzilishini yaxshiroq aks ettirish uchun bir xil atomlarning ayrimlari alohida ko'rsatilganda topiladi.
- Strukturaviy formula. Molekuladagi atomlarning nisbiy joylashuvi grafik tarzda ko'rsatilgan. Atomlar orasidagi kimyoviy bog'lanishlar chiziqlar bilan ko'rsatilgan. Ikki o'lchovli (2D) va uch o'lchovli (3D) formulalar mavjud. Ikki o'lchovlilar materiya tuzilishining tekislikdagi aksidir. Uch o'lchovlilar bizga uning tarkibini, nisbiy holatini, aloqalari va atomlar orasidagi masofani materiya tuzilishining nazariy modellariga eng yaqinroq ko'rsatishga imkon beradi.
- etanol
- Eng oddiy formula C 2 H 6 O
- Haqiqiy, empirik yoki yalpi formula: C 2 H 6 O
- Ratsional formula: C 2 H 5 OH
- Yarim kengaytirilgan shaklda ratsional formula: CH 3 CH 2 OH
- Strukturaviy formula (2D):
Kimyoviy formulalarni yozishning boshqa usullari mavjud. Yangi usullar 1980-yillarning oxirida shaxsiy kompyuterlar texnologiyasining rivojlanishi bilan paydo bo'ldi (SMILES, WLN, ROSDAL, SLN va boshqalar). Shaxsiy kompyuterlar kimyoviy formulalar bilan ishlash uchun molekulyar muharrirlar deb ataladigan maxsus dasturlardan ham foydalanadi.
Eslatmalar
- 1 2 3 Kimyoning asosiy tushunchalari - de.gubkin.ru/chemistry/ch1-th/node6.html
Ushbu tezis ruscha Vikipediyadagi maqolaga asoslangan. Sinxronizatsiya 10.07.11 17:38:37 da yakunlandi
Shunga o'xshash tezislar:
Birikmalarning yalpi, strukturaviy va elektron formulalari
Vutlerovning ikkinchi postulati. Atomlarning ma'lum guruhlarining kimyoviy reaktivligi sezilarli darajada ularning kimyoviy muhitiga, ya'ni ma'lum bir guruh qaysi atomlar yoki atomlar guruhlariga qo'shni bo'lishiga bog'liq.
Biz noorganik kimyoni o'rganishda foydalangan birikmalar formulalari faqat molekuladagi ma'lum bir element atomlarining sonini aks ettiradi. Bunday formulalar "yalpi formulalar" yoki "molekulyar formulalar" deb ataladi.
Vutlerovning birinchi postulatidan kelib chiqadiki, organik kimyoda nafaqat molekuladagi ma'lum atomlarning soni, balki ularning bog'lanish tartibi ham muhim, ya'ni organik birikmalar uchun yalpi formulalardan foydalanish har doim ham tavsiya etilmaydi. Masalan, aniqlik uchun metan molekulasining tuzilishini ko'rib chiqishda biz strukturaviy formulalardan foydalandik - atomlarning molekulaga bog'lanish tartibining sxematik tasviri. Strukturaviy formulalarni tasvirlashda kimyoviy bog'lanish chiziqcha, qo'sh bog'lanish ikki chiziqcha va boshqalar bilan belgilanadi.
Elektron formula (yoki Lyuis formulasi) strukturaviy formulaga juda o'xshaydi, lekin bu holda hosil bo'lgan bog'lanishlar emas, balki elektronlar, ham bog'lanish hosil qiluvchilar, ham bog'lanmaydiganlar ifodalanadi.
Masalan, allaqachon muhokama qilingan sulfat kislotasi quyidagi formulalar yordamida yozilishi mumkin. Yalpi formula H 2 80 4, strukturaviy va elektron formulalar quyidagicha:
Strukturaviy formulalar organik birikmalar
Deyarli barcha organik moddalar molekulalardan iborat bo'lib, ularning tarkibi kimyoviy formulalar bilan ifodalanadi, masalan, CH 4, C 4 H 10, C 2 H 4 O 2. Organik moddalar molekulalari qanday tuzilishga ega? Bu savolni 19-asr oʻrtalarida organik kimyo asoschilari F.Kekule va A.M.Vutlerovlar oʻzlariga berishgan. Turli xil organik moddalarning tarkibi va xususiyatlarini o'rganib, ular quyidagi xulosalarga kelishdi:
Organik moddalar molekulalaridagi atomlar valentligiga ko'ra ma'lum bir ketma-ketlikda kimyoviy bog'lar orqali bog'lanadi. Bu ketma-ketlik odatda kimyoviy tuzilish deb ataladi;
Barcha organik birikmalardagi uglerod atomlari chotivalent, boshqa elementlar esa o'ziga xos valentlikni namoyon qiladi.
Bu pozitsiya 1861 yilda O. M. Butlerov tomonidan tuzilgan organik birikmalar tuzilishi nazariyasining asosi hisoblanadi.
Organik birikmalarning kimyoviy tuzilishi vizual ravishda strukturaviy formulalar bilan ifodalanadi, unda atomlar orasidagi kimyoviy bog'lanishlar tire bilan ko'rsatilgan. Har bir elementning belgisidan cho'zilgan chiziqlarning umumiy soni uning atom valentligiga teng. Bir nechta bog'lanishlar ikki yoki uchta chiziq bilan ifodalanadi.
To'yingan uglevodorod propan C 3 H 8 misolidan foydalanib, organik moddaning struktura formulasini qanday tuzishni ko'rib chiqaylik.
1. Uglerod skeletini chizing. Bunday holda, zanjir uchta uglerod atomidan iborat:
S-S- BILAN
2. Uglerod tetravalentdir, shuning uchun biz har bir uglerod atomining etarli emas xususiyatlarini shunday tasvirlaymizki, har bir atomning yonida to'rtta xususiyat mavjud:

3. Vodorod atomlarining belgilarini qo‘shing:

Ko'pincha strukturaviy formulalar C - H aloqasini tasvirlamasdan qisqartirilgan shaklda yoziladi.
CH 3 - CH 2 - CH 3.
Strukturaviy formulalar faqat atomlarning ulanish ketma-ketligini ko'rsatadi, lekin molekulalarning fazoviy tuzilishini, xususan, bog'lanish burchaklarini aks ettirmaydi. Ma'lumki, masalan, propandagi C aloqalari orasidagi burchak 109,5 ° dir. Biroq, propanning strukturaviy formulasi bu burchak 180 ° ga o'xshaydi. Shuning uchun propanning strukturaviy formulasini kamroq qulay, ammo haqiqiyroq shaklda yozish to'g'riroq bo'ladi:
Professional kimyogarlar quyidagi tuzilish formulalaridan foydalanadilar, ularda na uglerod atomlari, na vodorod atomlari umuman ko'rsatilmaydi, faqat uglerod skeleti o'zaro bog'langan CC aloqalari, shuningdek, funktsional guruhlar shaklida tasvirlangan. Orqa miya bitta uzluksiz chiziqqa o'xshamasligini ta'minlash uchun kimyoviy bog'lanishlar bir-biriga burchak ostida tasvirlangan. Shunday qilib, C 3 H 8 propan molekulasida faqat ikkita C-C aloqasi mavjud, shuning uchun propan ikkita chiziq bilan ifodalanadi.
Organik birikmalarning gomologik qatori
Keling, bir xil sinfdagi ikkita birikmaning, masalan, spirtning struktura formulalarini ko'rib chiqaylik:

Metil CH 3 OH va etil C 2 H 5 OH spirtlarining molekulalari bir xil funktsional guruhga ega OH , butun spirtlar sinfiga xosdir, lekin uglerod skeletining uzunligi bilan farqlanadi: etanolda yana bitta uglerod atomi mavjud. Strukturaviy formulalarni taqqoslaganda, uglerod zanjiri bitta uglerod atomiga ko'payganda, moddaning tarkibi CH 2 guruhiga, uglerod zanjiri ikki atomga uzaytirilganda - ikkita CH 2 guruhiga va boshqalarga o'zgarishini ko'rish mumkin.
O'xshash tuzilishga ega bo'lgan, lekin tarkibida bir yoki bir nechta CH 2 guruhlari bilan farq qiladigan bir xil sinfning birikmalari gomologlar deyiladi.
CH 2 guruhi gomologik farq deb ataladi. Barcha gomologlarning yig'indisi homologik qator hosil qiladi. Metanol va etanol homolog spirtlar qatoriga kiradi. Xuddi shu seriyadagi barcha moddalar o'xshash kimyoviy xususiyatlarga ega va ularning tarkibi umumiy formula bilan ifodalanishi mumkin. Masalan, spirtlarning gomologik qatorining umumiy formulasi C n H 2 n +1 VON, bu erda n - natural son.
|
Ulanish klassi |
Umumiy formula |
Funktsional guruhni ajratib ko'rsatadigan umumiy formula |
|
Alkanlar |
C n H 2 n + 2 |
|
|
Sikloalkani |
C n H 2 n |
|
|
Alkenlar |
C n H 2 n |
|
|
Alkadieni |
C n H 2 n-2 |
|
|
Alkini |
C n H 2 n-2 |
|
|
Mononuklear arenalar (benzolga homolog qator) |
C n H 2 n-6 |
|
|
Bir atomli spirtlar |
C n H 2 n + 2 V |
C n H 2 n +1 V H |
|
Ko'p atomli spirtlar |
C n H 2 n + 2 O x |
C n H 2 n + 2-x (B H) x |
|
Aldegidlar |
C n H 2 n B |
C n H 2 n +1 CHO |
|
Monobasik karboksilik kislotalar |
C n H 2 n O 2 |
C n H 2 n +1 COOH |
|
Esterlar |
C n H 2 n B |
C n H 2 n +1 COOC n H 2n+1 |
|
Uglevodlar |
C n (H 2 O) m |
|
|
Birlamchi aminlar |
C n H 2 n + 3 N |
C n H 2 n +1 NH 2 |
|
Aminokislotalar |
C n H 2 n +1 NO |
H 2 NC n H 2n COOH |


 Molekulyar yoki yalpi formula molekulaga qaysi atomlar va qanday miqdorda kiritilganligini ko'rsatadi, masalan, C 6 H 6 CH 4 O C 2 H 3 Cl. O Molekulyar formula molekulaning tuzilishini aks ettirmaydi: molekulani tashkil etuvchi atomlarning tabiati, ularning soni va ularning bir-biri bilan bog'lanish ketma-ketligi, shuningdek, o'zaro bog'lanish turi. atomlar.
Molekulyar yoki yalpi formula molekulaga qaysi atomlar va qanday miqdorda kiritilganligini ko'rsatadi, masalan, C 6 H 6 CH 4 O C 2 H 3 Cl. O Molekulyar formula molekulaning tuzilishini aks ettirmaydi: molekulani tashkil etuvchi atomlarning tabiati, ularning soni va ularning bir-biri bilan bog'lanish ketma-ketligi, shuningdek, o'zaro bog'lanish turi. atomlar.

 To'rt uglerod atomiga ega bo'lgan uglevodorodlar tarmoqlangan, to'g'ri zanjirli yoki tsiklik uglerod skeletiga ega bo'lishi mumkin: Molekuladagi atomlar bitta, qo'sh yoki uch aloqalar bilan bog'lanishi mumkin:
To'rt uglerod atomiga ega bo'lgan uglevodorodlar tarmoqlangan, to'g'ri zanjirli yoki tsiklik uglerod skeletiga ega bo'lishi mumkin: Molekuladagi atomlar bitta, qo'sh yoki uch aloqalar bilan bog'lanishi mumkin:
 Molekulalarning elektron va strukturaviy formulalari molekulalarning fazoviy tuzilishini aks ettirmaydi. Molekulalarning atom-orbital modellari Oddiy chiziq (valentlik chizig'i) chizma tekisligida yotgan orbitallarning o'qlarini tasvirlaydi; qattiq takoz chizilgan tekislik ustida joylashgan AO ga to'g'ri keladi; chizilgan xanjar bu tekislikdan tashqariga yo'naltirilgan AOni ifodalaydi.
Molekulalarning elektron va strukturaviy formulalari molekulalarning fazoviy tuzilishini aks ettirmaydi. Molekulalarning atom-orbital modellari Oddiy chiziq (valentlik chizig'i) chizma tekisligida yotgan orbitallarning o'qlarini tasvirlaydi; qattiq takoz chizilgan tekislik ustida joylashgan AO ga to'g'ri keladi; chizilgan xanjar bu tekislikdan tashqariga yo'naltirilgan AOni ifodalaydi.



 Bu jarayonning mohiyati boshlang'ich moddalardagi kimyoviy bog'lanishlarning uzilishi va reaktsiya mahsulotlarida yangi bog'larning paydo bo'lishidan iborat. Organik reaksiyalar tenglamalar ko'rinishida emas, balki reaksiya sxemalari ko'rinishida yoziladi, bunda reaksiyaga kirishuvchi moddalarning stexiometrik nisbatiga emas, balki reaksiya sharoitlariga e'tibor beriladi. Ushbu sxemalarda boshlang'ich mahsulotlar (reagentlar) reaksiya mahsulotlaridan strelka bilan ajratiladi, uning ustida reaksiya sharoitlari va katalizatorlar, strelka ostida esa minus belgisi bilan reaksiya jarayonida hosil bo'lgan birikmalar ko'rsatiladi.
Bu jarayonning mohiyati boshlang'ich moddalardagi kimyoviy bog'lanishlarning uzilishi va reaktsiya mahsulotlarida yangi bog'larning paydo bo'lishidan iborat. Organik reaksiyalar tenglamalar ko'rinishida emas, balki reaksiya sxemalari ko'rinishida yoziladi, bunda reaksiyaga kirishuvchi moddalarning stexiometrik nisbatiga emas, balki reaksiya sharoitlariga e'tibor beriladi. Ushbu sxemalarda boshlang'ich mahsulotlar (reagentlar) reaksiya mahsulotlaridan strelka bilan ajratiladi, uning ustida reaksiya sharoitlari va katalizatorlar, strelka ostida esa minus belgisi bilan reaksiya jarayonida hosil bo'lgan birikmalar ko'rsatiladi.


 Parchalanish reaksiyalari: Parchalanish reaksiyasi natijasida murakkab organik modda molekulasidan bir necha unchalik murakkab yoki oddiy moddalar hosil boʻladi: Katta molekulalarning uglerod skeletining qizdirilganda va katalizatorlar ishtirokida boʻlinishi (yuqori haroratda parchalanish reaksiyalari). Piroliz deb ataladi) Past molekulyar og'irlikdagi birikma molekulasi qo'shni ikkita C-atomidan (bog'larning ko'pligini oshiradi) yoki boshqa atomlardan uzilib, halqa hosil qiladi.
Parchalanish reaksiyalari: Parchalanish reaksiyasi natijasida murakkab organik modda molekulasidan bir necha unchalik murakkab yoki oddiy moddalar hosil boʻladi: Katta molekulalarning uglerod skeletining qizdirilganda va katalizatorlar ishtirokida boʻlinishi (yuqori haroratda parchalanish reaksiyalari). Piroliz deb ataladi) Past molekulyar og'irlikdagi birikma molekulasi qo'shni ikkita C-atomidan (bog'larning ko'pligini oshiradi) yoki boshqa atomlardan uzilib, halqa hosil qiladi.
 Reaktiv molekulada ikkita yangi bog' hosil bo'ladi. Bunday holda, reaktivning bog'lanish nisbati kamayadi. Atom yoki atomlar guruhi boshqa atom yoki atomlar guruhi bilan almashtiriladi: Boshlang'ich modda va reaktsiya mahsuloti izomerlardir (strukturaviy yoki fazoviy).
Reaktiv molekulada ikkita yangi bog' hosil bo'ladi. Bunday holda, reaktivning bog'lanish nisbati kamayadi. Atom yoki atomlar guruhi boshqa atom yoki atomlar guruhi bilan almashtiriladi: Boshlang'ich modda va reaktsiya mahsuloti izomerlardir (strukturaviy yoki fazoviy).
 Reaksiyalarni yo'nalish bo'yicha tasniflash Bir xil sharoitlarda to'g'ridan-to'g'ri va teskari yo'nalishlarda sodir bo'lishi mumkin bo'lgan kimyoviy reaktsiya. To'g'ridan-to'g'ri va teskari reaktsiyalar tezligi tenglashganda (kimyoviy muvozanat holati) qaytariladigan reaktsiya tugaydi. Bu deyarli bir yo'nalishda ketadi.
Reaksiyalarni yo'nalish bo'yicha tasniflash Bir xil sharoitlarda to'g'ridan-to'g'ri va teskari yo'nalishlarda sodir bo'lishi mumkin bo'lgan kimyoviy reaktsiya. To'g'ridan-to'g'ri va teskari reaktsiyalar tezligi tenglashganda (kimyoviy muvozanat holati) qaytariladigan reaktsiya tugaydi. Bu deyarli bir yo'nalishda ketadi.



 Radikal reaktsiyalar uchun shartlar: ko'tarilgan harorat (ko'pincha reaktsiya gaz fazasida amalga oshiriladi), yorug'lik yoki radioaktiv nurlanish, qutbsiz erituvchilar, erkin radikallar (boshlovchilar) manbalari bo'lgan birikmalarning mavjudligi qutbsiz va kuchsiz qutbli birikmalarga xosdir. Bunday aloqalar (masalan, C–C, C–H, Cl–Cl, O–O va boshqalar) gomolitik boʻlinishga moyil.
Radikal reaktsiyalar uchun shartlar: ko'tarilgan harorat (ko'pincha reaktsiya gaz fazasida amalga oshiriladi), yorug'lik yoki radioaktiv nurlanish, qutbsiz erituvchilar, erkin radikallar (boshlovchilar) manbalari bo'lgan birikmalarning mavjudligi qutbsiz va kuchsiz qutbli birikmalarga xosdir. Bunday aloqalar (masalan, C–C, C–H, Cl–Cl, O–O va boshqalar) gomolitik boʻlinishga moyil.
 Geterolitik reaksiyalar (ionli) Umumiy reaksiya sxemasi: CH 3)3 C Cl + H 2 O (CH 3)3 C-OH + HCl Jarayon bosqichlari
Geterolitik reaksiyalar (ionli) Umumiy reaksiya sxemasi: CH 3)3 C Cl + H 2 O (CH 3)3 C-OH + HCl Jarayon bosqichlari
 Ion reaktsiyalarini o'tkazish shartlari: past harorat; hosil bo'lgan ionlarni hal qilishga qodir qutbli erituvchilar. Bunday reaksiyalar qutbli (C-O, C-N, C-Cl) va yuqori qutblanish xususiyatiga ega (C=C, C=C-C=C, C=O va boshqalar) boʻlgan birikmalarga xosdir. Bog'lanish qanchalik qutbli bo'lsa, ion mexanizmi orqali uzilishi shunchalik oson bo'ladi!!!
Ion reaktsiyalarini o'tkazish shartlari: past harorat; hosil bo'lgan ionlarni hal qilishga qodir qutbli erituvchilar. Bunday reaksiyalar qutbli (C-O, C-N, C-Cl) va yuqori qutblanish xususiyatiga ega (C=C, C=C-C=C, C=O va boshqalar) boʻlgan birikmalarga xosdir. Bog'lanish qanchalik qutbli bo'lsa, ion mexanizmi orqali uzilishi shunchalik oson bo'ladi!!!










 1815 yilda frantsuz kimyogari Biot optik yoki oyna izomeriyasining yangi turini kashf etdi. U buni topdi. suyuq yoki erigan holatda bo'lgan organik moddalar qutblangan yorug'lik tekisligini aylantiradi.
1815 yilda frantsuz kimyogari Biot optik yoki oyna izomeriyasining yangi turini kashf etdi. U buni topdi. suyuq yoki erigan holatda bo'lgan organik moddalar qutblangan yorug'lik tekisligini aylantiradi.
 Polarizatsiya tekisligini o'zgartiruvchi (aylanuvchi) birikmalar optik faol deb ataladi, ular ikkita optik izomer shaklida mavjud; , va ulardan biri polarizatsiya tekisligini o'ngga aylantiradi, ikkinchisi esa bir xil burchak ostida, lekin chapga aylanadi. Ushbu aylanishlarni ko'rsatish uchun optik izomer formulasi oldiga qo'yilgan (+) va (-) belgilaridan foydalaniladi. Barcha optik faol moddalar molekulalarida kamida bitta assimetrik uglerod atomi (formulalarda bu atom yulduzcha bilan belgilanadi), ya'ni to'rt xil atom yoki atomlar guruhi bilan bog'langan uglerodni o'z ichiga oladi.
Polarizatsiya tekisligini o'zgartiruvchi (aylanuvchi) birikmalar optik faol deb ataladi, ular ikkita optik izomer shaklida mavjud; , va ulardan biri polarizatsiya tekisligini o'ngga aylantiradi, ikkinchisi esa bir xil burchak ostida, lekin chapga aylanadi. Ushbu aylanishlarni ko'rsatish uchun optik izomer formulasi oldiga qo'yilgan (+) va (-) belgilaridan foydalaniladi. Barcha optik faol moddalar molekulalarida kamida bitta assimetrik uglerod atomi (formulalarda bu atom yulduzcha bilan belgilanadi), ya'ni to'rt xil atom yoki atomlar guruhi bilan bog'langan uglerodni o'z ichiga oladi.
 Asimmetrik uglerod atomini o'z ichiga olgan har qanday organik birikma ikki fazoviy shakl (model) ko'rinishida ifodalanishi mumkin, ular kosmosga joylashtirilganda bir-biri bilan birlashtirilmaydi. Bu ikki shakl (model) bir-biridan ob'ekt sifatida uning oynadagi tasviridan farq qiladi. Shuning uchun bu izomeriya "oyna" izomeriya deb ataladi. oyna Butanol-2 ning optik izomerlari
Asimmetrik uglerod atomini o'z ichiga olgan har qanday organik birikma ikki fazoviy shakl (model) ko'rinishida ifodalanishi mumkin, ular kosmosga joylashtirilganda bir-biri bilan birlashtirilmaydi. Bu ikki shakl (model) bir-biridan ob'ekt sifatida uning oynadagi tasviridan farq qiladi. Shuning uchun bu izomeriya "oyna" izomeriya deb ataladi. oyna Butanol-2 ning optik izomerlari
 Kosmosda birlashtirib bo'lmaydigan (uning ustiga qo'yilganda) va bir-biriga ob'ekt kabi uning oyna tasviriga bog'liq bo'lgan molekulalar (yoki ularning modellari) chiral (yunoncha cheiros - qo'l, qo'l o'xshashligi) deb ataladi. Misol tariqasida qo'llanganda bir-biriga mos kelmaydigan o'ng va chap qo'llar bo'lishi mumkin. Shunday qilib, optik izomeriya chirallik tufayli yuzaga kelgan hodisadir.
Kosmosda birlashtirib bo'lmaydigan (uning ustiga qo'yilganda) va bir-biriga ob'ekt kabi uning oyna tasviriga bog'liq bo'lgan molekulalar (yoki ularning modellari) chiral (yunoncha cheiros - qo'l, qo'l o'xshashligi) deb ataladi. Misol tariqasida qo'llanganda bir-biriga mos kelmaydigan o'ng va chap qo'llar bo'lishi mumkin. Shunday qilib, optik izomeriya chirallik tufayli yuzaga kelgan hodisadir.
 Optik faol moddalarni qog'ozda tasvirlashda E. Fisher tomonidan taklif qilingan proyeksiya formulalari qo'llaniladi. Fisher formulasi
Optik faol moddalarni qog'ozda tasvirlashda E. Fisher tomonidan taklif qilingan proyeksiya formulalari qo'llaniladi. Fisher formulasi

 Proyeksiya formulasidagi gidroksil assimetrik uglerod atomining o'ng tomonida joylashgan optik faol birikmalar D-seriyaga, chapda esa L-seriyaga tegishli ekanligi shartli ravishda qabul qilingan. Bunday standart sifatida glitseraldegid D(+)-glitseraldegid L(-)-gliseraldegid tanlandi.
Proyeksiya formulasidagi gidroksil assimetrik uglerod atomining o'ng tomonida joylashgan optik faol birikmalar D-seriyaga, chapda esa L-seriyaga tegishli ekanligi shartli ravishda qabul qilingan. Bunday standart sifatida glitseraldegid D(+)-glitseraldegid L(-)-gliseraldegid tanlandi.
 Konformatsion izomeriya Atom guruhlari oddiy bog'lanishlar atrofida ichki aylansa, konformatsiyalar deb ataladigan turli fazoviy tuzilmalar paydo bo'ladi. Bu harakatlar molekulalarning tuzilishini buzmaydi. C-H bog'lari atrofidagi ichki aylanish molekulalardagi atomlarning fazoviy yo'nalishini o'zgartira olmaydi (shuning uchun metan molekulasining turli konformatsiyalari paydo bo'lmaydi). Biroq, etan molekulasidagi C-C aloqasi atrofida aylanish juda ko'p turli xil konformatsiyalarga olib keladi. Eng muhimi va bir-biridan farq qiladiganlari tutilgan va inhibe qilingan konformatsiyalar deyiladi. Konformatsiyalar fazoviy va proyeksiya formulalari bilan tasvirlangan. Bunday holda, Nyuman proyeksiyasi deb ataladigan narsa qo'llaniladi: molekula shunday yo'naltirilganki, atrofida aylanish sodir bo'ladigan bog'lanish aylananing markaziga proyeksiyalanadi va kuzatuvchiga eng yaqin atomdan bog'lanishlar tasvirlangan. aylana markazidan chiqadigan chiziqlar va uzoq atomdan chiqadigan bog'lanishlar doiradan tashqarida chizilgan.
Konformatsion izomeriya Atom guruhlari oddiy bog'lanishlar atrofida ichki aylansa, konformatsiyalar deb ataladigan turli fazoviy tuzilmalar paydo bo'ladi. Bu harakatlar molekulalarning tuzilishini buzmaydi. C-H bog'lari atrofidagi ichki aylanish molekulalardagi atomlarning fazoviy yo'nalishini o'zgartira olmaydi (shuning uchun metan molekulasining turli konformatsiyalari paydo bo'lmaydi). Biroq, etan molekulasidagi C-C aloqasi atrofida aylanish juda ko'p turli xil konformatsiyalarga olib keladi. Eng muhimi va bir-biridan farq qiladiganlari tutilgan va inhibe qilingan konformatsiyalar deyiladi. Konformatsiyalar fazoviy va proyeksiya formulalari bilan tasvirlangan. Bunday holda, Nyuman proyeksiyasi deb ataladigan narsa qo'llaniladi: molekula shunday yo'naltirilganki, atrofida aylanish sodir bo'ladigan bog'lanish aylananing markaziga proyeksiyalanadi va kuzatuvchiga eng yaqin atomdan bog'lanishlar tasvirlangan. aylana markazidan chiqadigan chiziqlar va uzoq atomdan chiqadigan bog'lanishlar doiradan tashqarida chizilgan.