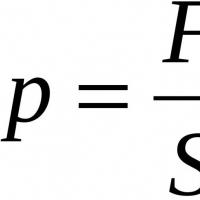Хемиска формула. Хемиски препарат за топлина и dpa сеопфатно издание Вовед во азот. Амини
пресметување на количината на отпад, приносот на полупроизводи, бруто тежина, нето маса, маса на готовиот производ.
1. Пресметка на количината на отпад при механичка кулинарска обработка
(М отх.) :
M otkh.=M b*O/100, каде
М отпад - маса на отпад при механичка кулинарска обработка, g (kg);
M b – бруто маса, g (kg);
2. Пресметка на приносот на полупроизводи (Mp/f):
M p/f=M b*B p/f/100, каде
M p/f – тежина на полупроизводот, g (kg);
M b – бруто тежина, g (kg)
Во полупроизвод – принос на полупроизвод, %
3. Пресметка на бруто маса (М б):
M b=M n *100/(100-O), каде
M b – бруто маса, g (kg);
M n – нето тежина, g (kg);
О – отпад од механичка кулинарска обработка, %
4. Пресметка на нето маса (M n):
M n = M b*(100-O)/100, каде
M n – нето тежина, g (kg);
M b – бруто маса, g (kg);
О – отпад од механичка кулинарска обработка, %
5. Пресметка на масата на готовиот производ (М подготвен):
М подготвен = M n * (100-P t.o.)/100, каде
M n – нето тежина, g (kg);
M n=M подготвен*100/(100-P така), каде
M n – нето тежина, g (kg);
М готик. – маса на готовиот производ, g (kg);
П т.о. – загуби при термичка обработка, %
6. Формули за пресметување на хранливата и енергетската вредност на кулинарските производи:
6.1 Содржина на хранливи материи во производот (К):
К=М Н *ДО spr /100, каде
МН – нето маса на производот според рецептот, g;
6.2 Количина на прехранбена супстанција по термичка обработка (P):
P=ΣK*P spr /100, каде
P – количина на прехранбена супстанција по термичка обработка (g, mg, μg);
ΣK – вкупна содржина на саканата хранлива материја во садот (g, mg, μg);
P spr – зачувување на прехранбените материи во сад во согласност со референтната книга, %.
6.3 П spr = 100 - П п.в. (%), каде
П п.в. – губење на прехранбени материи како резултат на термичка обработка (според референтната книга), %.
Додаток 3
РАЗВОЈ НА ТЕХНОЛОШКИ КАРТИ
Технолошка карта за јавните угостителски производи е технички документ составен врз основа на збирка рецепти за јадења, кулинарски производи, пекарски и кондиторски производи од брашно или техничко-технолошка карта. Технолошката карта го означува името на претпријатието, изворот на рецептот (Збирка рецепти, годината на нејзиното објавување, бројот и верзијата на рецептот или презимето, името, патронимот на авторот, годината и бројот на техничко-технолошката карта).
Кога се опишува рецептот, се наведува стапката на потрошувачка на производи по 1 порција (на 1000 g) во грамови и за најчесто повторуваните серии на производи произведени во дадено претпријатие во kg. Рецептите укажуваат на количината на сол, зачини, билки и други производи, кои во збирките обично се наведени во текстот или во табелата 28 „Потрошувачка на сол и зачини при подготовка на јадења и производи“.
Технологијата за подготовка на јадење, кулинарски или кондиторски производ е опишана последователно, со означување на употребената опрема и инвентар. Кога ја опишувате технологијата, наведете ги параметрите на технолошкиот процес: времетраење на термичка обработка (мин), температура (°C) итн.; редослед на презентација и послужување на храната. Дадени се показатели за органолептички квалитет: изглед, конзистентност, боја, вкус и мирис.
Во согласност со правилата за давање на јавни угостителски услуги, производителот на кулинарски производи е должен да ги информира потрошувачите за хранливата и енергетската вредност на јадењата, кулинарските, брашното и кондиторските производи. Затоа, се препорачува да се обезбедат информации за хранливата и енергетската вредност на садот (производот) во технолошката карта.
Додаток (А2) дава примерок технолошка карта.
Па, за да го комплетираме нашето запознавање со алкохолите, ќе ја дадам и формулата на друга добро позната супстанција - холестерол. Не секој знае дека тоа е монохидричен алкохол!
|`/`\\`|<`|w>`\`/|<`/w$color(red)HO$color()>\/`|0/`|/\<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`\|dH; #a_(A-72)<_(A-120,d+)>-/-/<->`\
Ја означив хидроксилната група во неа со црвено.
Карбоксилни киселини
Секој производител на вино знае дека виното треба да се чува без пристап до воздух. Во спротивно ќе се закисели. Но, хемичарите ја знаат причината - ако додадете уште еден атом на кислород во алкохолот, добивате киселина.Ајде да ги погледнеме формулите на киселини кои се добиваат од алкохоли кои веќе ни се познати:
| Супстанција | Скелетна формула | Бруто формула | ||
|---|---|---|---|---|
| Метанска киселина (мравја киселина) |
H/C`|O|\OH | HCOOH | O//\OH | |
| Етаноична киселина (оцетна киселина) |
H-C-C\O-H; H|#C|H | CH3-COOH | /`|О|\OH | |
| Пропанска киселина (метилоцетна киселина) |
H-C-C-C\O-H; H|#2|H; H|#3|H | CH3-CH2-COOH | \/`|О|\OH | |
| Бутаноична киселина (бутерна киселина) |
H-C-C-C-C\O-H; H|#2|H; H|#3|H; H|#4|H | CH3-CH2-CH2-COOH | /\/`|O|\OH | |
| Генерализирана формула | (R)-C\ О-Х | (R)-COOH или (R)-CO2H | (R)/`|O|\OH |
Карактеристична карактеристика на органските киселини е присуството на карбоксилна група (COOH), која на таквите супстанции им дава кисели својства.
Секој што пробал оцет знае дека е многу кисел. Причината за тоа е присуството на оцетна киселина во него. Вообичаено, трпезниот оцет содржи помеѓу 3 и 15% оцетна киселина, а остатокот (најчесто) вода. Потрошувачката на оцетна киселина во неразредена форма претставува опасност по животот.
Карбоксилните киселини можат да имаат повеќе карбоксилни групи. Во овој случај тие се нарекуваат: двоосновен, триосновниитн...
Прехранбените производи содржат многу други органски киселини. Еве само неколку од нив:
Името на овие киселини одговара на прехранбените производи во кои се содржани. Патем, имајте предвид дека тука има киселини кои исто така имаат хидроксилна група, карактеристична за алкохолите. Таквите супстанции се нарекуваат хидроксикарбоксилни киселини(или хидрокси киселини).
На дното, под секоја од киселините, има знак кој го наведува името на групата органски материи на кои припаѓа.
Радикали
Радикалите се уште еден концепт што влијаел на хемиските формули. Самиот збор веројатно им е познат на сите, но во хемијата радикалите немаат ништо заедничко со политичарите, бунтовниците и другите граѓани со активна позиција.
Овде ова се само фрагменти од молекули. И сега ќе откриеме што ги прави посебни и ќе се запознаеме со нов начин на пишување хемиски формули.
Во текстот веќе неколку пати се споменати генерализирани формули: алкохоли - (R)-OH и карбоксилни киселини - (R)-COOH. Да ве потсетам дека -OH и -COOH се функционални групи. Но, Р е радикал. Не е за ништо што тој е прикажан како буквата Р.
Да бидеме поконкретни, едновалентен радикал е дел од молекула на која му недостасува еден атом на водород. Па, ако одземете два атоми на водород, ќе добиете двовалентен радикал.
Радикалите во хемијата добија свои имиња. Некои од нив дури добија латински ознаки слични на ознаките на елементите. И покрај тоа, понекогаш во формулите радикалите може да се наведат во скратена форма, што повеќе потсетува на бруто формули.
Сето ова е прикажано во следната табела.
| Име | Структурна формула | Означување | Кратка формула | Пример за алкохол | ||
|---|---|---|---|---|---|---|
| Метил | CH3-() | Јас | CH3 | (Јас)-ОХ | CH3OH | |
| Етил | CH3-CH2-() | Et | C2H5 | (Et)-OH | C2H5OH | |
| пресеков | CH3-CH2-CH2-() | Пр | C3H7 | (Пр)-ОХ | C3H7OH | |
| Изопропил | H3C\CH(*`/H3C*)-() | i-Pr | C3H7 | (i-Pr)-OH | (CH3)2CHOH | |
| Фенил | `/`=`\//-\\-{} | д-р | C6H5 | (Ph)-OH | C6H5OH | |
Мислам дека се е јасно овде. Само сакам да ви го свртам вниманието на колумната каде се дадени примери на алкохоли. Некои радикали се напишани во форма што наликува на бруто формулата, но функционалната група е напишана одделно. На пример, CH3-CH2-OH се претвора во C2H5OH.
И за разгранети ланци како изопропил, се користат структури со загради.
Постои и таков феномен како слободни радикали. Тоа се радикали кои поради некоја причина се одвоиле од функционалните групи. Во овој случај, едно од правилата со кои почнавме да ги проучуваме формулите е прекршено: бројот на хемиски врски повеќе не одговара на валентноста на еден од атомите. Па, или можеме да кажеме дека една од врските станува отворена на едниот крај. Слободните радикали обично живеат кратко време бидејќи молекулите имаат тенденција да се вратат во стабилна состојба.
Вовед во азот. Амини
Предлагам да се запознаам со уште еден елемент кој е дел од многу органски соединенија. Ова азот.
Се означува со латинската буква Ни има валентност од три.
Ајде да видиме кои супстанции се добиваат ако се додаде азот на познатите јаглеводороди:
| Супстанција | Проширена структурна формула | Поедноставена структурна формула | Скелетна формула | Бруто формула |
|---|---|---|---|---|
| Аминометан (метиламин) |
H-C-N\H;H|#C|H | CH3-NH2 | \NH2 | |
| Аминоетан (етиламин) |
H-C-C-N\H;H|#C|H;H|#3|H | CH3-CH2-NH2 | /\NH2 | |
| Диметиламин | H-C-N<`|H>-C-H; H|#-3|H; H|#2|H | $L(1,3)H/N<_(A80,w+)CH3>\dCH3 | /Н<_(y-.5)H>\ | |
| Аминобензен (Анилин) |
H\N|C\\C|C<\H>`//C<|H>`\C<`/H>`||C<`\H>/ | NH2|C\\CH|CH`//C<_(y.5)H>`\HC`||HC/ | NH2|\|`/`\`|/_o | |
| Триетиламин | $slope(45)H-C-C/N\C-C-H;H|#2|H; H|#3|H; H|#5|H;H|#6|H; #N`|C<`-H><-H>`|C<`-H><-H>`|H | CH3-CH2-N<`|CH2-CH3>-CH2-CH3 | \/N<`|/>\| |
Како што веројатно веќе погодивте од имињата, сите овие супстанции се обединети под општото име амини. Се нарекува функционалната група ()-NH2 амино група. Еве неколку општи формули на амини:
Во принцип, тука нема посебни иновации. Ако овие формули ви се јасни, тогаш можете безбедно да се вклучите во понатамошно проучување на органската хемија користејќи учебник или Интернет.
Но, би сакал да зборувам и за формули во неорганската хемија. Ќе видите колку е лесно да ги разберете откако ќе ја проучувате структурата на органските молекули.
Рационални формули
Не треба да се заклучи дека неорганската хемија е полесна од органската хемија. Се разбира, неорганските молекули имаат тенденција да изгледаат многу поедноставни, бидејќи тие немаат тенденција да формираат сложени структури како јаглеводороди. Но, тогаш треба да проучиме повеќе од сто елементи што го сочинуваат периодниот систем. И овие елементи имаат тенденција да се комбинираат според нивните хемиски својства, но со бројни исклучоци.
Значи, нема да ви кажам ништо од ова. Темата на мојата статија е хемиски формули. И со нив сè е релативно едноставно.
Најчесто се користи во неорганската хемија рационални формули. И сега ќе откриеме како тие се разликуваат од оние што веќе ни се познати.
Прво, да се запознаеме со уште еден елемент - калциум. Ова е исто така многу чест елемент.
Таа е назначена Caи има валентност од два. Ајде да видиме какви соединенија формира со јаглеродот, кислородот и водородот што ги знаеме.
| Супстанција | Структурна формула | Рационална формула | Бруто формула |
|---|---|---|---|
| Калциум оксид | Ca=O | CaO | |
| Калциум хидроксид | H-O-Ca-O-H | Ca(OH)2 | |
| Калциум карбонат | $slope(45)Ca`/O\C|O`|/O`\#1 | CaCO3 | |
| Калциум бикарбонат | HO/`|O|\O/Ca\O/`|O|\OH | Ca(HCO3)2 | |
| Јаглеродна киселина | H|O\C|O`|/O`|H | H2CO3 |
На прв поглед, може да се види дека рационалната формула е нешто помеѓу структурна и бруто формула. Но, сè уште не е многу јасно како се добиваат. За да го разберете значењето на овие формули, треба да ги земете предвид хемиските реакции во кои учествуваат супстанциите.
Калциумот во својата чиста форма е мек бел метал. Тоа не се јавува во природата. Но, сосема е можно да се купи во продавница за хемикалии. Обично се чува во посебни тегли без пристап до воздух. Бидејќи во воздухот реагира со кислород. Всушност, затоа не се појавува во природата.
Значи, реакцијата на калциум со кислород:
2Ca + O2 -> 2CaO
Бројот 2 пред формулата на супстанцијата значи дека во реакцијата се вклучени 2 молекули.
Калциумот и кислородот произведуваат калциум оксид. Оваа супстанца исто така не се појавува во природата бидејќи реагира со вода:
CaO + H2O -> Ca(OH2)
Резултатот е калциум хидроксид. Ако внимателно ја погледнете неговата структурна формула (во претходната табела), можете да видите дека ја формираат еден атом на калциум и две хидроксилни групи, со кои веќе сме запознаени.
Ова се законите на хемијата: ако се додаде хидроксилна група на органска супстанција, се добива алкохол, а ако се додаде на метал, се добива хидроксид.
Но, калциум хидроксид не се јавува во природата поради присуството на јаглерод диоксид во воздухот. Мислам дека сите слушнале за овој гас. Се формира при дишење на луѓе и животни, согорување на јаглен и нафтени продукти, при пожари и вулкански ерупции. Затоа, секогаш е присутен во воздухот. Но, исто така, доста добро се раствора во вода, формирајќи јаглеродна киселина:
CO2 + H2O<=>H2CO3
Потпишете<=>покажува дека реакцијата може да продолжи во двете насоки под исти услови.
Така, калциум хидроксид, растворен во вода, реагира со јаглеродна киселина и се претвора во малку растворлив калциум карбонат:
Ca(OH)2 + H2CO3 -> CaCO3"|v" + 2H2O
Стрелката надолу значи дека како резултат на реакцијата супстанцијата преципитира.
Со понатамошен контакт на калциум карбонат со јаглерод диоксид во присуство на вода, се јавува реверзибилна реакција за да се формира кисела сол - калциум бикарбонат, која е многу растворлива во вода
CaCO3 + CO2 + H2O<=>Ca(HCO3)2
Овој процес влијае на тврдоста на водата. Како што се зголемува температурата, бикарбонатот повторно се претвора во карбонат. Затоа, во регионите со тврда вода, бигорот се формира во котлиња.
Креда, варовник, мермер, туф и многу други минерали во голема мера се составени од калциум карбонат. Го има и во коралите, школките од мекотели, животинските коски итн...
Но, ако калциум карбонатот се загрее на многу висока топлина, тој ќе се претвори во калциум оксид и јаглерод диоксид.
Оваа кратка приказна за циклусот на калциум во природата треба да објасни зошто се потребни рационални формули. Значи, рационалните формули се напишани така што функционалните групи се видливи. Во нашиот случај тоа е:
Покрај тоа, поединечните елементи - Ca, H, O (во оксиди) - се исто така независни групи.Јони
Мислам дека е време да се запознаеме со јоните. Овој збор веројатно им е познат на сите. И по проучувањето на функционалните групи, не нè чини ништо да откриеме што се овие јони.
Општо земено, природата на хемиските врски обично е дека некои елементи се откажуваат од електрони додека други ги добиваат. Електроните се честички со негативен полнеж. Елемент со целосен комплемент електрони има нула полнеж. Ако даде електрон, тогаш неговиот полнеж станува позитивен, а ако го прифати, тогаш станува негативен. На пример, водородот има само еден електрон, од кој лесно се откажува, претворајќи се во позитивен јон. Постои посебен запис за ова во хемиските формули:
H2O<=>H^+ + OH^-
Овде го гледаме тоа како резултат електролитичка дисоцијацијаводата се распаѓа на позитивно наелектризиран водороден јон и негативно наелектризирана OH група. Се нарекува јонот OH^- хидроксид јон. Не треба да се меша со хидроксилната група, која не е јон, туку дел од некаква молекула. Знакот + или - во горниот десен агол го покажува полнењето на јонот.
Но, јаглеродната киселина никогаш не постои како независна супстанција. Всушност, тоа е мешавина од водородни јони и карбонатни јони (или бикарбонатни јони):
H2CO3 = H^+ + HCO3^-<=>2H^+ + CO3^2-
Карбонатниот јон има полнеж од 2-. Тоа значи дека на него се додадени два електрони.
Негативно наелектризираните јони се нарекуваат анјони. Обично тие вклучуваат киселински остатоци.
Позитивно наелектризирани јони - катјони. Најчесто тоа се водород и метали.
И тука веројатно можете целосно да го разберете значењето на рационалните формули. Во нив прво се запишува катјонот, а потоа анјонот. Дури и ако формулата не содржи никакви обвиненија.
Веројатно веќе претпоставувате дека јоните можат да се опишат не само со рационални формули. Еве ја скелетната формула на бикарбонатниот анјон:
Овде полнењето е означено директно до атомот на кислород, кој добил дополнителен електрон и затоа изгубил една линија. Едноставно кажано, секој дополнителен електрон го намалува бројот на хемиски врски прикажани во структурната формула. Од друга страна, ако некој јазол од структурната формула има знак +, тогаш има дополнителен стап. Како и секогаш, овој факт треба да се докаже со пример. Но, меѓу супстанциите познати на нас не постои ниту еден катјон кој се состои од неколку атоми.
И таква супстанција е амонијак. Неговиот воден раствор често се нарекува амонијаки е вклучен во секој комплет за прва помош. Амонијак е соединение на водород и азот и има рационална формула NH3. Размислете за хемиската реакција што се случува кога амонијакот се раствора во вода:
NH3 + H2O<=>NH4^+ + OH^-
Истото, но користејќи структурни формули:
H|N<`/H>\H + H-O-H<=>H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
На десната страна гледаме два јона. Тие се формирани како резултат на движење на еден водороден атом од молекула на вода во молекула на амонијак. Но, овој атом се движеше без својот електрон. Анјонот веќе ни е познат - тоа е јон на хидроксид. И катјонот се нарекува амониум. Покажува својства слични на металите. На пример, може да се комбинира со кисел остаток. Супстанцијата формирана со комбинирање на амониум со карбонат анјон се нарекува амониум карбонат: (NH4)2CO3.
Еве ја реакционата равенка за интеракцијата на амониум со карбонат анјон, напишана во форма на структурни формули:
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-\C|O`|/O^-<=>H|N^+<`/H><_(A75,w+)H>_(A15,d+)H`|0O^-\C|O`|/O^-|0H_(A-15,d-)N^+<_(A105,w+)H><\H>`|H
Но, во оваа форма, равенката на реакцијата е дадена за демонстративни цели. Обично равенките користат рационални формули:
2NH4^+ + CO3^2-<=>(NH4)2CO3
Ридски систем
Значи, можеме да претпоставиме дека веќе сме ги проучувале структурните и рационалните формули. Но, постои уште едно прашање што вреди да се разгледа подетално. Како бруто формулите се разликуваат од рационалните?
Знаеме зошто рационалната формула на јаглеродна киселина е напишана H2CO3, а не на некој друг начин. (Двата водородни катјони се на прво место, а потоа карбонатниот анјон.) Но, зошто бруто формулата е напишана CH2O3?
Во принцип, рационалната формула на јаглеродна киселина може да се смета за вистинска формула, бидејќи нема елементи што се повторуваат. За разлика од NH4OH или Ca(OH)2.
Но, дополнително правило многу често се применува на бруто формули, што го одредува редоследот на елементите. Правилото е прилично едноставно: прво се става јаглеродот, потоа водородот, а потоа останатите елементи по азбучен ред.
Така излегува CH2O3 - јаглерод, водород, кислород. Ова се нарекува систем Хил. Се користи во скоро сите хемиски референтни книги. И во оваа статија исто така.
Малку за системот easyChem
Наместо заклучок, би сакал да зборувам за системот easyChem. Тој е дизајниран така што сите формули за кои разговаравме овде може лесно да се вметнат во текстот. Всушност, сите формули во оваа статија се нацртани со помош на easyChem.
Зошто воопшто ни е потребен некаков систем за изведување формули? Работата е дека стандардниот начин за прикажување информации во интернет прелистувачите е јазикот за означување на хипертекст (HTML). Тој е фокусиран на обработка на текстуални информации.
Рационалните и бруто формули може да се прикажат со користење на текст. Дури и некои поедноставени структурни формули може да се напишат во текст, на пример алкохол CH3-CH2-OH. Иако за ова ќе треба да го користите следниов запис во HTML: CH 3- CH 2-Ох.
Ова секако создава некои тешкотии, но можете да живеете со нив. Но, како да се прикаже структурната формула? Во принцип, можете да користите monospace фонт:
H H | | H-C-C-O-H | | H H Секако дека не изгледа многу убаво, но исто така е изводливо.
Вистинскиот проблем доаѓа кога се обидувате да нацртате бензенски прстени и кога користите скелетни формули. Нема друг начин освен поврзување растерска слика. Растерите се чуваат во посебни датотеки. Прелистувачите може да вклучуваат слики во формат gif, png или jpeg.
За да креирате такви датотеки, потребен е графички уредувач. На пример, Photoshop. Но, јас сум запознаен со Photoshop повеќе од 10 години и со сигурност можам да кажам дека е многу слабо прилагоден за прикажување хемиски формули.
Молекуларните уредници многу подобро се справуваат со оваа задача. Но, со голем број формули, од кои секоја е зачувана во посебна датотека, сосема е лесно да се збуните во нив.
На пример, бројот на формули во оваа статија е . Тие се прикажани во форма на графички слики (останатите со помош на HTML алатки).
Системот easyChem ви овозможува да ги зачувате сите формули директно во HTML документ во текстуална форма. Според мое мислење, ова е многу погодно.
Покрај тоа, бруто формулите во овој член се пресметуваат автоматски. Бидејќи easyChem работи во две фази: прво описот на текстот се претвора во информациска структура (график), а потоа може да се извршат различни дејства на оваа структура. Меѓу нив, може да се забележат следните функции: пресметка на молекуларна тежина, претворање во бруто формула, проверка на можноста за излез како текст, графички и текст.
Така, за подготовка на оваа статија користев само уредувач на текст. Освен тоа, не требаше да размислувам која од формулите ќе биде графичка, а која текст.
Еве неколку примери кои ја откриваат тајната на подготвувањето на текстот на статијата: Описите од левата колона автоматски се претвораат во формули во втората колона.
Во првата линија, описот на рационалната формула е многу сличен на прикажаниот резултат. Единствената разлика е во тоа што нумеричките коефициенти се прикажуваат интерлинеарно.
Во вториот ред, проширената формула е дадена во форма на три посебни синџири одделени со симбол; Мислам дека е лесно да се види дека текстуалниот опис на многу начини потсетува на дејствата што би биле потребни за да се прикаже формулата со молив на хартија.
Третата линија ја демонстрира употребата на коси линии користејќи ги симболите \ и /. Знакот ` (backtick) значи дека линијата е повлечена од десно кон лево (или оддолу кон горе).
Овде има многу подетална документација за користење на системот easyChem.
Дозволете ми да ја завршам оваа статија и да ви посакам среќа во изучувањето на хемијата.
Краток објаснувачки речник на термини користени во статијата
Јаглеводороди Супстанции кои се состојат од јаглерод и водород. Тие се разликуваат едни од други по структурата на нивните молекули. Структурните формули се шематски слики на молекулите, каде што атомите се означуваат со латински букви, а хемиските врски со цртички. Структурните формули се проширени, поедноставени и скелетни. Проширените структурни формули се структурни формули каде што секој атом е претставен како посебен јазол. Поедноставени структурни формули се оние структурни формули каде што атоми на водород се запишани покрај елементот со кој се поврзани. И ако повеќе од еден водород е прикачен на еден атом, тогаш количината се запишува како број. Можеме да кажеме и дека групите делуваат како јазли во поедноставените формули. Скелетните формули се структурни формули каде атомите на јаглеродот се претставени како празни јазли. Бројот на водородни атоми поврзани со секој јаглероден атом е еднаков на 4 минус бројот на врски што се спојуваат на локацијата. За јазли формирани не од јаглерод, важат правилата за поедноставени формули. Бруто формула (исто така позната како вистинска формула) - список на сите хемиски елементи што ја сочинуваат молекулата, означувајќи го бројот на атоми во форма на број (ако има еден атом, тогаш единицата не е напишана) Хил систем - правило кое го одредува редоследот на атомите во бруто формулата: прво се става јаглеродот, потоа водородот, а потоа останатите елементи по азбучен ред. Ова е систем кој се користи многу често. И сите бруто формули во оваа статија се напишани според системот Хил. Функционални групи Стабилни комбинации на атоми кои се зачувани при хемиски реакции. Често функционалните групи имаат свои имиња и влијаат на хемиските својства и научното име на супстанцијата преземетеАпстракт на тема:
Хемиска формула
Хемиска формула- одраз на информации за составот и структурата на супстанциите со користење на хемиски симболи, бројки и ознаки за делење - загради.
Составот на молекулите на сложените супстанции се изразува со користење на хемиски формули.
Врз основа на хемиската формула, може да се даде името на супстанцијата.
Хемиската формула се залага за:
- 1 молекула или 1 мол супстанција;
- квалитативен состав (од кои хемиски елементи се состои супстанцијата);
- квантитативен состав (колку атоми од секој елемент содржи една молекула на супстанцијата).
- Формулата HNO3 се залага за:
- азотна киселина;
- 1 молекула азотна киселина или 1 мол азотна киселина;
- квалитативен состав: молекулата на азотна киселина се состои од водород, азот и кислород;
- квантитативен состав: молекулата на азотна киселина содржи еден атом од елементот водород, еден атом од елементот азот, три атоми од елементот кислород.
Видови
Во моментов, се разликуваат следниве видови хемиски формули:
- Наједноставната формула. Може да се добие експериментално со одредување на односот на хемиските елементи во супстанцијата користејќи ги вредностите на атомската маса на елементите. Значи, наједноставната формула на вода ќе биде H 2 O, а наједноставната формула на бензен CH (за разлика од C 6 H 6 - точно, видете подолу). Атомите во формулите се означени со знаци на хемиски елементи, а нивните релативни количини се означени со бројки во формат на подлога.
- Вистинска формула. Може да се добие ако е позната молекуларната тежина на супстанцијата. Вистинската формула на водата е H 2 O, што се совпаѓа со наједноставната. Вистинската формула на бензен е C 6 H 6, која се разликува од наједноставната. Вистинските формули се нарекуваат и бруто формули или емпириски. Тие го рефлектираат составот, но не и структурата на молекулите на супстанцијата. Вистинската формула го покажува точниот број на атоми на секој елемент во една молекула. Оваа количина одговара на индекс - мал број по симболот на соодветниот елемент. Ако индексот е 1, односно има само еден атом од даден елемент во молекулата, тогаш таков индекс не е означен.
- Рационална формула. Рационалните формули ги истакнуваат групите на атоми карактеристични за класите на хемиски соединенија. На пример, за алкохолите е распределена групата -OH. Кога пишувате рационална формула, таквите групи на атоми се затворени во загради (OH). Бројот на групи што се повторуваат се означува со броеви во формат на подлога, кои се ставаат веднаш по затворачката заграда. Квадратни загради се користат за да се одрази структурата на сложените соединенија. На пример, К4 е калиум хексацијанокобалтоат. Рационалните формули често се наоѓаат во полу-проширена форма, кога некои од истите атоми се прикажани одделно за подобро да ја рефлектираат структурата на молекулата на супстанцијата.
- Структурна формула. Графички го прикажува релативниот распоред на атомите во молекулата. Хемиските врски помеѓу атомите се означени со линии. Постојат дводимензионални (2D) и тридимензионални (3D) формули. Дводимензионалните се одраз на структурата на материјата на рамнина. Тридимензионалните овозможуваат да се претстават неговиот состав, релативна положба, врски и растојанија помеѓу атомите најблиску до теоретските модели на структурата на материјата.
- Етанол
- Наједноставната формула е C 2 H 6 O
- Вистинска, емпириска или бруто формула: C 2 H 6 O
- Рационална формула: C 2 H 5 OH
- Рационална формула во полупроширена форма: CH 3 CH 2 OH
- Структурна формула (2D):
Постојат и други начини за пишување хемиски формули. Нови методи се појавија во доцните 1980-ти со развојот на технологијата за персонални компјутери (SMILES, WLN, ROSDAL, SLN итн.). Личните компјутери користат и специјален софтвер наречен молекуларни уредници за работа со хемиски формули.
Белешки
- 1 2 3 Основни концепти на хемијата - de.gubkin.ru/chemistry/ch1-th/node6.html
Овој апстракт е заснован на статија од руската Википедија. Синхронизацијата е завршена 07/10/11 17:38:37
Слични апстракти:
Бруто, структурни и електронски формули на соединенија
Втор постулат на Вутлеров. Хемиската реактивност на одредени групи на атоми значително зависи од нивната хемиска средина, односно од кои атоми или групи атоми е соседна одредена група.
Формулите на соединенијата што ги користевме во проучувањето на неорганската хемија го одразуваат само бројот на атоми на одреден елемент во молекулата. Таквите формули се нарекуваат „бруто формули“ или „молекуларни формули“.
Како што следува од првиот постулат на Вутлеров, во органската хемија не е важен само бројот на одредени атоми во молекулата, туку и редоследот на нивното врзување, односно не е секогаш препорачливо да се користат бруто формули за органски соединенија. На пример, за јасност, кога ја разгледувавме структурата на молекулата на метанот, користевме структурни формули - шематски приказ на редоследот на поврзување на атомите во молекулата. Кога се прикажуваат структурни формули, хемиската врска се означува со цртичка, двојната врска со две цртички итн.
Електронската формула (или формулата на Луис) е многу слична со структурната формула, но во овој случај не се претставени формираните врски, туку електроните, и оние што формираат врска и оние што не формираат врска.
На пример, сулфатната киселина, веќе дискутирана, може да се напише со помош на следните формули. Бруто формулата е H 2 80 4, структурните и електронските формули се како што следува:
Структурни формули органски соединенија
Речиси сите органски супстанции се состојат од молекули, чиј состав се изразува со хемиски формули, на пример CH 4, C 4 H 10, C 2 H 4 O 2. Каква структура имаат молекулите на органските материи? Основачите на органската хемија, Ф. Кекуле и А. М. Вутлеров, си го поставиле ова прашање во средината на 19 век. Проучувајќи го составот и својствата на различни органски супстанции, тие дојдоа до следните заклучоци:
Атомите во молекулите на органските материи се поврзани со хемиски врски во одредена низа, според нивната валентност. Оваа низа обично се нарекува хемиска структура;
Атомите на јаглеродот во сите органски соединенија се хотивалентни, а другите елементи ги покажуваат нивните карактеристични валентни.
Оваа позиција е основа на теоријата за структурата на органските соединенија, формулирана од О. М. Батлеров во 1861 година.
Хемиската структура на органските соединенија е визуелно претставена со структурни формули, во кои хемиските врски меѓу атомите се означени со цртички. Вкупниот број на линии што се протегаат од симболот на секој елемент е еднаков на неговата атомска валентност. Повеќекратните врски се претставени со две или три цртички.
Користејќи го примерот на заситениот јаглеводороден пропан C 3 H 8, да разгледаме како да ја составиме структурната формула на органска супстанција.
1. Нацртајте јаглероден скелет. Во овој случај, ланецот се состои од три јаглеродни атоми:
S-S-СО
2. Јаглеродот е четиривалентен, така што ние прикажуваме недоволни карактеристики од секој јаглероден атом на таков начин што има четири карактеристики до секој атом:

3. Додадете ги симболите на атомите на водород:

Честопати структурните формули се напишани во скратена форма, без да се прикаже врската C - H Скратените структурни формули се многу покомпактни од проширените.
CH 3 - CH 2 - CH 3.
Структурните формули ја покажуваат само низата на врски на атомите, но не ја рефлектираат просторната структура на молекулите, особено аглите на врската. Познато е, на пример, дека аголот помеѓу C врските во пропанот е 109,5°. Сепак, структурната формула на пропан изгледа како овој агол да е 180°. Затоа, би било поправилно да се напише структурната формула на пропан во помалку погодна, но повистинска форма:
Професионалните хемичари ги користат следните структурни формули, во кои воопшто не се прикажани ниту јаглеродни атоми ниту атоми на водород, туку само јаглеродниот скелет е прикажан во форма на меѓусебно поврзани C-C врски, како и функционални групи. За да се осигура дека 'рбетот не изгледа како една континуирана линија, хемиските врски се прикажани под агол една до друга. Значи, во молекулата на пропан C 3 H 8 има само две врски C-C, така што пропанот е претставен со две цртички.
Хомологна серија на органски соединенија
Да ги разгледаме структурните формули на две соединенија од иста класа, на пример алкохоли:

Молекулите на метил CH 3 OH и етил C 2 H 5 OH алкохоли имаат иста функционална група OH, заедничка за целата класа на алкохоли, но се разликуваат по должината на јаглеродниот скелет: во етанолот има уште еден јаглероден атом. Споредувајќи ги структурните формули, може да се забележи дека кога јаглеродниот синџир се зголемува за еден јаглероден атом, составот на супстанцијата се менува во група CH 2, кога јаглеродниот синџир е издолжен за два атома - до две групи CH 2 итн.
Соединенијата од иста класа, кои имаат слична структура, но се разликуваат во составот за една или повеќе CH 2 групи, се нарекуваат хомолози.
Групата CH 2 се нарекува хомологна разлика. Севкупноста на сите хомолози формира хомолошка серија. Метанолот и етанолот припаѓаат на хомологната серија на алкохоли. Сите супстанции од истата серија имаат слични хемиски својства, а нивниот состав може да се изрази со општа формула. На пример, општата формула на хомологната серија на алкохоли е C n H 2 n +1 VON, каде што n - природен број.
|
Класа за поврзување |
Општа формула |
Општа формула што ја истакнува функционалната група |
|
Алканите |
C n H 2 n + 2 |
|
|
Циклоалкани |
C n H 2 n |
|
|
Алкени |
C n H 2 n |
|
|
Алкадиени |
C n H 2 n-2 |
|
|
Алкини |
C n H 2 n-2 |
|
|
Мононуклеарни арени (хомологни серии на бензен) |
C n H 2 n-6 |
|
|
Монохидрични алкохоли |
C n H 2 n + 2 V |
C n H 2 n +1 V H |
|
Полихидрични алкохоли |
C n H 2 n + 2 O x |
C n H 2 n + 2-x (B H) x |
|
Алдехиди |
C n H 2 n B |
C n H 2 n +1 CHO |
|
Монобазни карбоксилни киселини |
C n H 2 n O 2 |
C n H 2 n +1 COOH |
|
Естери |
C n H 2 n B |
C n H 2 n +1 COOC n H 2n+1 |
|
Јаглехидрати |
C n (H 2 O) m |
|
|
Примарни амини |
C n H 2 n + 3 N |
C n H 2 n +1 NH 2 |
|
Амино киселини |
C n H 2 n +1 NO |
H 2 NC n H 2n COOH |


 Молекуларната или бруто формулата покажува кои атоми и во која количина се вклучени во молекулата, на пример C 6 H 6 CH 4 O C 2 H 3 Cl. O Молекуларната формула не ја одразува структурата на молекулата Структурната формула мора да ја одразува: природата на атомите што ја сочинуваат молекулата, нивниот број и редоследот на нивната поврзаност меѓу себе, како и видот на врската помеѓу. атомите.
Молекуларната или бруто формулата покажува кои атоми и во која количина се вклучени во молекулата, на пример C 6 H 6 CH 4 O C 2 H 3 Cl. O Молекуларната формула не ја одразува структурата на молекулата Структурната формула мора да ја одразува: природата на атомите што ја сочинуваат молекулата, нивниот број и редоследот на нивната поврзаност меѓу себе, како и видот на врската помеѓу. атомите.

 Јаглеводородите со четири јаглеродни атоми можат да имаат разгранет, директно ланец или цикличен јаглероден скелет: атомите во молекулата можат да се поврзат со единечни, двојни или тројни врски:
Јаглеводородите со четири јаглеродни атоми можат да имаат разгранет, директно ланец или цикличен јаглероден скелет: атомите во молекулата можат да се поврзат со единечни, двојни или тројни врски:
 Електронските и структурните формули на молекулите не ја одразуваат просторната структура на молекулите. Атомско-орбитални модели на молекули Едноставна линија (валентна линија) ги прикажува оските на орбиталите кои лежат во рамнината на цртежот; цврстиот клин одговара на AO лоциран над рамнината на цртање; изведениот клин го претставува АО насочен надвор од оваа рамнина.
Електронските и структурните формули на молекулите не ја одразуваат просторната структура на молекулите. Атомско-орбитални модели на молекули Едноставна линија (валентна линија) ги прикажува оските на орбиталите кои лежат во рамнината на цртежот; цврстиот клин одговара на AO лоциран над рамнината на цртање; изведениот клин го претставува АО насочен надвор од оваа рамнина.



 Суштината на овој процес е кршење на хемиските врски во почетните супстанции и формирање на нови врски во производите на реакцијата. Органските реакции се пишуваат не во форма на равенки, туку во форма на шеми на реакција, во кои се посветува внимание не толку на стехиометрискиот сооднос на реактантите колку на условите на реакцијата. Во овие шеми, почетните производи (реагенси) се одвоени од производите на реакцијата со стрелка, над која се означени условите за реакција и катализаторите, а под стрелката со знак минус - соединенија кои се формираат за време на реакцијата.
Суштината на овој процес е кршење на хемиските врски во почетните супстанции и формирање на нови врски во производите на реакцијата. Органските реакции се пишуваат не во форма на равенки, туку во форма на шеми на реакција, во кои се посветува внимание не толку на стехиометрискиот сооднос на реактантите колку на условите на реакцијата. Во овие шеми, почетните производи (реагенси) се одвоени од производите на реакцијата со стрелка, над која се означени условите за реакција и катализаторите, а под стрелката со знак минус - соединенија кои се формираат за време на реакцијата.


 Реакции на распаѓање: Како резултат на реакцијата на распаѓање, неколку помалку сложени или едноставни супстанции се формираат од молекула на сложена органска супстанција: Расцепување на јаглеродниот скелет на големи молекули за време на загревањето и во присуство на катализатори (реакции на распаѓање на високи температури се нарекуваат пиролиза) Молекулата на соединението со мала молекуларна тежина се отцепува од два соседни С-атоми (зголемување на множеството на врската) или од други атоми за да се формира прстен
Реакции на распаѓање: Како резултат на реакцијата на распаѓање, неколку помалку сложени или едноставни супстанции се формираат од молекула на сложена органска супстанција: Расцепување на јаглеродниот скелет на големи молекули за време на загревањето и во присуство на катализатори (реакции на распаѓање на високи температури се нарекуваат пиролиза) Молекулата на соединението со мала молекуларна тежина се отцепува од два соседни С-атоми (зголемување на множеството на врската) или од други атоми за да се формира прстен
 Во молекулата на реактантот се формираат две нови врски. Во овој случај, односот на врската на реактантот се намалува. Атом или група атоми се заменуваат со друг атом или група атоми: Почетната супстанција и производот на реакцијата се изомери (структурни или просторни).
Во молекулата на реактантот се формираат две нови врски. Во овој случај, односот на врската на реактантот се намалува. Атом или група атоми се заменуваат со друг атом или група атоми: Почетната супстанција и производот на реакцијата се изомери (структурни или просторни).
 Класификација на реакции по насока Хемиска реакција која, под исти услови, може да се случи во напред и обратен правец. Кога ќе се изедначат брзините на напредните и обратните реакции (состојба на хемиска рамнотежа), реверзибилната реакција завршува. Тоа оди речиси до крај во една насока.
Класификација на реакции по насока Хемиска реакција која, под исти услови, може да се случи во напред и обратен правец. Кога ќе се изедначат брзините на напредните и обратните реакции (состојба на хемиска рамнотежа), реверзибилната реакција завршува. Тоа оди речиси до крај во една насока.



 Услови за радикални реакции: покачена температура (често реакцијата се изведува во гасна фаза), изложеност на светлина или радиоактивно зрачење, неполарни растворувачи, присуство на соединенија кои се извори на слободни радикали (иницијатори). се типични за соединенија со неполарни и слабо поларни врски. Таквите врски (на пример, C-C, C-H, Cl-Cl, O-O, итн.) се склони кон хомолитичко расцепување
Услови за радикални реакции: покачена температура (често реакцијата се изведува во гасна фаза), изложеност на светлина или радиоактивно зрачење, неполарни растворувачи, присуство на соединенија кои се извори на слободни радикали (иницијатори). се типични за соединенија со неполарни и слабо поларни врски. Таквите врски (на пример, C-C, C-H, Cl-Cl, O-O, итн.) се склони кон хомолитичко расцепување
 Хетеролитички реакции (јонски) Општа шема на реакции: CH 3)3 C Cl + H 2 O (CH 3)3 C-OH + HCl Фази на процесот
Хетеролитички реакции (јонски) Општа шема на реакции: CH 3)3 C Cl + H 2 O (CH 3)3 C-OH + HCl Фази на процесот
 Услови за спроведување на јонски реакции: ниска температура; поларни растворувачи способни за солвација на добиените јони. Ваквите реакции се типични за соединенија со поларни врски (C-O, C-N, C-Cl) и врски со висока поларизација (C=C, C=C-C=C, C=O итн.). Колку е пополарна врската, толку полесно се раскинува преку јонскиот механизам!!!
Услови за спроведување на јонски реакции: ниска температура; поларни растворувачи способни за солвација на добиените јони. Ваквите реакции се типични за соединенија со поларни врски (C-O, C-N, C-Cl) и врски со висока поларизација (C=C, C=C-C=C, C=O итн.). Колку е пополарна врската, толку полесно се раскинува преку јонскиот механизам!!!










 Во 1815 година, францускиот хемичар Биот открил нов тип на оптички или огледален изомеризам. Тој откри дека некои. органските материи во течна или растворена состојба ја ротираат рамнината на поларизираната светлина.
Во 1815 година, францускиот хемичар Биот открил нов тип на оптички или огледален изомеризам. Тој откри дека некои. органските материи во течна или растворена состојба ја ротираат рамнината на поларизираната светлина.
 Соединенијата што ја менуваат (ротираат) рамнината на поларизација се нарекуваат оптички активни, тие постојат во форма на два оптички изомери. , и Едниот од нив ја ротира рамнината на поларизација надесно, а другиот ротира за истиот агол, но налево. За означување на овие ротации се користат знаците (+) и (-), кои се поставени пред формулата на оптичката изомер. Сите оптички активни супстанции содржат во нивните молекули најмалку еден асиметричен јаглероден атом (во формулите овој атом се означува со ѕвездичка), т.е. јаглерод кој е поврзан со четири различни атоми или групи атоми
Соединенијата што ја менуваат (ротираат) рамнината на поларизација се нарекуваат оптички активни, тие постојат во форма на два оптички изомери. , и Едниот од нив ја ротира рамнината на поларизација надесно, а другиот ротира за истиот агол, но налево. За означување на овие ротации се користат знаците (+) и (-), кои се поставени пред формулата на оптичката изомер. Сите оптички активни супстанции содржат во нивните молекули најмалку еден асиметричен јаглероден атом (во формулите овој атом се означува со ѕвездичка), т.е. јаглерод кој е поврзан со четири различни атоми или групи атоми
 Секое органско соединение кое содржи асиметричен јаглероден атом може да се претстави во форма на две просторни форми (модели), кои, кога се надредени во просторот, не можат да се комбинираат едни со други. Овие две форми (модели) се разликуваат една од друга како предмет од неговата огледална слика. Затоа, овој изомеризам се нарекува изомеризам „огледало“. огледало Оптички изомери на бутанол-2
Секое органско соединение кое содржи асиметричен јаглероден атом може да се претстави во форма на две просторни форми (модели), кои, кога се надредени во просторот, не можат да се комбинираат едни со други. Овие две форми (модели) се разликуваат една од друга како предмет од неговата огледална слика. Затоа, овој изомеризам се нарекува изомеризам „огледало“. огледало Оптички изомери на бутанол-2
 Молекулите (или нивните модели) кои не можат да се комбинираат во просторот (кога се надредени) и кои се поврзуваат едни со други како објект со неговата огледална слика се нарекуваат хирални (од грчкиот cheiros - рака, сличност со раката). Пример би биле рацете - десно и лево, кои не се вклопуваат заедно кога се применуваат. Така, оптичкиот изомеризам е феномен поради хиралноста.
Молекулите (или нивните модели) кои не можат да се комбинираат во просторот (кога се надредени) и кои се поврзуваат едни со други како објект со неговата огледална слика се нарекуваат хирални (од грчкиот cheiros - рака, сличност со раката). Пример би биле рацете - десно и лево, кои не се вклопуваат заедно кога се применуваат. Така, оптичкиот изомеризам е феномен поради хиралноста.
 При прикажување на оптички активни супстанции на хартија, се користат формули за проекција предложени од Е. Фишер. Формула на Фишер
При прикажување на оптички активни супстанции на хартија, се користат формули за проекција предложени од Е. Фишер. Формула на Фишер

 Конвенционално беше прифатено дека оптички активните соединенија во кои хидроксилот во проекционата формула се наоѓа десно од асиметричниот јаглероден атом припаѓаат на серијата D, а лево - на серијата L. Глицералдехид D(+)-глицералдехид L(-)-глицералдехид беше избран како таков стандард
Конвенционално беше прифатено дека оптички активните соединенија во кои хидроксилот во проекционата формула се наоѓа десно од асиметричниот јаглероден атом припаѓаат на серијата D, а лево - на серијата L. Глицералдехид D(+)-глицералдехид L(-)-глицералдехид беше избран како таков стандард
 Конформациона изомеризам Кога групи на атоми внатрешно ротираат околу едноставни врски, се јавуваат различни просторни структури наречени конформации. Овие движења не ја нарушуваат структурата на молекулите. Внатрешната ротација околу врските C-H не може да ја промени просторната ориентација на атомите во молекулите (затоа, не се појавуваат различни конформации на молекулата на метанот). Сепак, ротацијата околу врската C-C во молекулата на етанот резултира со огромна разновидност на конформации. Најважните и најразлични една од друга се нарекуваат затемнети и инхибирани конформации. Конформациите се прикажани и со просторни и со проекциски формули. Во овој случај, се користи т.н. линии што произлегуваат од центарот на кругот, а врските што произлегуваат од далечниот атом се нацртани линии надвор од кругот.
Конформациона изомеризам Кога групи на атоми внатрешно ротираат околу едноставни врски, се јавуваат различни просторни структури наречени конформации. Овие движења не ја нарушуваат структурата на молекулите. Внатрешната ротација околу врските C-H не може да ја промени просторната ориентација на атомите во молекулите (затоа, не се појавуваат различни конформации на молекулата на метанот). Сепак, ротацијата околу врската C-C во молекулата на етанот резултира со огромна разновидност на конформации. Најважните и најразлични една од друга се нарекуваат затемнети и инхибирани конформации. Конформациите се прикажани и со просторни и со проекциски формули. Во овој случај, се користи т.н. линии што произлегуваат од центарот на кругот, а врските што произлегуваат од далечниот атом се нацртани линии надвор од кругот.