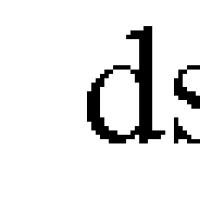Davr 2 elementlarning oksidlanish holati. Kimyoviy element atomining oksidlanish darajasini qanday aniqlash mumkin. Oksidlanish darajasi haqida tushuncha
Unsiklopediyadan olingan material
Oksidlanish darajasi birikmadagi atomning shartli zaryadi bo'lib, u faqat ionlardan iborat degan faraz asosida hisoblanadi. Ushbu tushunchaga ta'rif berishda shartli ravishda bog'lanish (valentlik) elektronlari ko'proq elektronegativ atomlarga o'tadi, deb taxmin qilinadi (qarang Elektromanfiylik ), shuning uchun birikmalar musbat va manfiy zaryadlangan ionlardan iborat. Oksidlanish raqami nol, manfiy va musbat qiymatlarga ega bo'lishi mumkin, ular odatda element belgisining tepasida joylashgan.
Erkin holatdagi elementlarning atomlariga nol oksidlanish darajasi beriladi, masalan: Cu, H2, N2, P4, S6. Birlashtiruvchi elektron buluti (elektron jufti) siljigan atomlar salbiy oksidlanish darajasiga ega. Ftor uchun uning barcha birikmalarida u -1 ga teng. Valentlik elektronlarini boshqa atomlarga beradigan atomlar ijobiy oksidlanish holatiga ega. Masalan, gidroksidi va ishqoriy tuproq metallari uchun mos ravishda +1 va +2 ga teng. Cl−, S2−, K+, Cu2+, Al3+ kabi oddiy ionlarda u ionning zaryadiga teng. Ko'pgina birikmalarda vodorod atomlarining oksidlanish darajasi +1, lekin metall gidridlarda (ularning vodorod bilan birikmalari) - NaH, CaH 2 va boshqalarda - 1 ga teng. Kislorod -2 oksidlanish darajasi bilan tavsiflanadi, lekin, masalan, ftor OF2 bilan birgalikda u +2, peroksid birikmalarida (BaO2 va boshqalar) -1 bo'ladi. Ba'zi hollarda bu qiymat kasr sifatida ifodalanishi mumkin: temir oksidi (II, III) Fe 3 O 4 tarkibidagi temir uchun u +8/3 ga teng.
Murakkab tarkibidagi atomlarning oksidlanish darajalarining algebraik yig'indisi nolga teng, kompleks ionda esa ionning zaryadi. Bu qoidadan foydalanib, masalan, H 3 PO 4 ortofosfor kislotasida fosforning oksidlanish darajasini hisoblaymiz. Uni x bilan belgilab, vodorod (+1) va kislorod (−2) ning oksidlanish darajasini ularning birikmadagi atomlari soniga ko‘paytirsak, tenglama hosil bo‘ladi: (+1) 3+x+(−2) 4=0 , bundan x=+5 . Xuddi shunday Cr 2 O 7 2− ionida xromning oksidlanish darajasini hisoblaymiz: 2x+(−2) 7=−2; x=+6. MnO, Mn 2 O 3, MnO 2, Mn 3 O 4, K 2 MnO 4, KMnO 4 birikmalarida marganetsning oksidlanish darajasi +2, +3, +4, +8/3, +6, mos ravishda +7.
Eng yuqori oksidlanish darajasi uning eng katta ijobiy qiymati hisoblanadi. Aksariyat elementlar uchun u davriy jadvaldagi guruh raqamiga teng va uning birikmalaridagi elementning muhim miqdoriy xarakteristikasi hisoblanadi. Elementning birikmalarida uchraydigan oksidlanish darajasining eng past qiymati odatda eng past oksidlanish darajasi deb ataladi; qolganlarning hammasi oraliq. Shunday qilib, oltingugurt uchun eng yuqori oksidlanish darajasi +6, eng pasti -2 va oraliq +4 ga teng.
Davriy tizim guruhlari bo'yicha elementlarning oksidlanish darajalarining o'zgarishi ularning kimyoviy xossalarining atom soni ortishi bilan davriyligini aks ettiradi.
Elementlarning oksidlanish darajasi tushunchasi moddalarni tasniflashda, xossalarini tavsiflashda, birikmalar formulalarini tuzishda va ularning xalqaro nomlarida foydalaniladi. Lekin u ayniqsa oksidlanish-qaytarilish reaktsiyalarini o'rganishda keng qo'llaniladi. "Oksidlanish darajasi" tushunchasi ko'pincha noorganik kimyoda "valentlik" tushunchasi o'rniga qo'llaniladi (qarang.
Oksidlanish darajasini qanday aniqlash mumkin? Davriy jadval har qanday kimyoviy element uchun ushbu miqdoriy qiymatni qayd etish imkonini beradi.
Ta'rif
Birinchidan, keling, ushbu atama nimani anglatishini tushunishga harakat qilaylik. Davriy jadvalga muvofiq oksidlanish darajasi kimyoviy o'zaro ta'sir jarayonida element tomonidan qabul qilingan yoki berilgan elektronlar sonini ifodalaydi. U salbiy va ijobiy qiymatni olishi mumkin.
Jadvalga ulanish
Oksidlanish darajasi qanday aniqlanadi? Davriy jadval vertikal ravishda joylashgan sakkiz guruhdan iborat. Ularning har biri ikkita kichik guruhga ega: asosiy va ikkilamchi. Elementlar uchun o'lchovlarni o'rnatish uchun siz ma'lum qoidalardan foydalanishingiz kerak.

Ko'rsatmalar
Elementlarning oksidlanish darajalarini qanday hisoblash mumkin? Jadval ushbu muammoni to'liq engishga imkon beradi. Birinchi guruhda (asosiy kichik guruh) joylashgan gidroksidi metallar birikmalarda oksidlanish darajasini ko'rsatadi, u ularning eng yuqori valentligiga teng + ga to'g'ri keladi. Ikkinchi guruh metallari (A kichik guruhi) +2 oksidlanish darajasiga ega.
Jadval bu qiymatni nafaqat metall xususiyatlarini ko'rsatadigan elementlar uchun, balki metall bo'lmaganlar uchun ham aniqlash imkonini beradi. Ularning maksimal qiymati eng yuqori valentlikka mos keladi. Masalan, oltingugurt uchun u +6, azot uchun +5 bo'ladi. Ularning minimal (eng past) ko'rsatkichi qanday hisoblanadi? Jadval bu savolga ham javob beradi. Guruh raqamini sakkizdan olib tashlashingiz kerak. Masalan, kislorod uchun -2, azot uchun -3 bo'ladi.
Boshqa moddalar bilan kimyoviy o'zaro ta'sirga kirmagan oddiy moddalar uchun belgilangan ko'rsatkich nolga teng deb hisoblanadi.
Keling, binar birikmalarda joylashish bilan bog'liq asosiy harakatlarni aniqlashga harakat qilaylik. Ularda oksidlanish holati qanday o'rnatiladi? Davriy jadval muammoni hal qilishga yordam beradi.
Masalan, kaltsiy oksidi CaO ni olaylik. Ikkinchi guruhning asosiy kichik guruhida joylashgan kaltsiy uchun qiymat doimiy bo'ladi, +2 ga teng. Metall bo'lmagan xususiyatlarga ega bo'lgan kislorod uchun bu ko'rsatkich salbiy qiymat bo'ladi va u -2 ga to'g'ri keladi. Ta'rifning to'g'riligini tekshirish uchun biz olingan raqamlarni umumlashtiramiz. Natijada, biz nolga erishamiz, shuning uchun hisob-kitoblar to'g'ri.
Shu kabi ko'rsatkichlarni boshqa CuO ikkilik birikmasida aniqlaymiz. Mis ikkilamchi kichik guruhda (birinchi guruh) joylashganligi sababli, o'rganilayotgan ko'rsatkich turli qiymatlarni ko'rsatishi mumkin. Shuning uchun, uni aniqlash uchun birinchi navbatda kislorod uchun indikatorni aniqlash kerak.
Ikkilik formulaning oxirida joylashgan nometall salbiy oksidlanish raqamiga ega. Ushbu element oltinchi guruhda joylashganligi sababli, sakkizdan oltitani ayirishda kislorodning oksidlanish darajasi -2 ga to'g'ri kelishini olamiz. Murakkabda indekslar yo'qligi sababli, misning oksidlanish darajasi ijobiy bo'ladi, +2 ga teng.
Kimyoviy jadval yana qanday ishlatiladi? Uch elementdan iborat formulalardagi elementlarning oksidlanish darajalari ham aniq algoritm yordamida hisoblanadi. Birinchidan, bu ko'rsatkichlar birinchi va oxirgi elementga joylashtiriladi. Birinchisi uchun bu ko'rsatkich valentlikka mos keladigan ijobiy qiymatga ega bo'ladi. Metall bo'lmagan eng tashqi element uchun bu ko'rsatkich manfiy qiymatga ega bo'lib, u farq sifatida aniqlanadi (guruh raqami sakkizdan chiqariladi); Markaziy elementning oksidlanish darajasini hisoblashda matematik tenglama qo'llaniladi. Hisoblashda har bir element uchun mavjud indekslar hisobga olinadi. Barcha oksidlanish darajalarining yig'indisi nolga teng bo'lishi kerak.

Sulfat kislotada aniqlashga misol
Ushbu birikmaning formulasi H 2 SO 4 dir. Vodorodning oksidlanish darajasi +1, kislorodning oksidlanish darajasi -2 ga teng. Oltingugurtning oksidlanish darajasini aniqlash uchun matematik tenglama tuzamiz: + 1 * 2 + X + 4 * (-2) = 0. Oltingugurtning oksidlanish darajasi +6 ga to'g'ri kelishini aniqlaymiz.

Xulosa
Qoidalardan foydalanib, redoks reaktsiyalarida koeffitsientlarni belgilashingiz mumkin. Bu masala maktab o'quv dasturining 9-sinf kimyo kursida muhokama qilinadi. Bundan tashqari, oksidlanish darajalari haqidagi ma'lumotlar OGE va USE vazifalarini bajarishga imkon beradi.
TA'RIF
Oksidlanish holati birikma tarkibidagi kimyoviy element atomi holatini uning elektromanfiyligidan kelib chiqqan holda miqdoriy baholashdir.
U ham ijobiy, ham salbiy qiymatlarni oladi. Murakkab tarkibidagi elementning oksidlanish darajasini ko'rsatish uchun uning belgisi ustiga tegishli belgisi ("+" yoki "-") bo'lgan arab raqamini qo'yish kerak.
Shuni esda tutish kerakki, oksidlanish darajasi jismoniy ma'noga ega bo'lmagan miqdordir, chunki u atomning haqiqiy zaryadini aks ettirmaydi. Biroq, bu tushuncha kimyoda juda keng qo'llaniladi.
Kimyoviy elementlarning oksidlanish darajalari jadvali
Maksimal musbat va minimal manfiy oksidlanish darajasini davriy jadval D.I. yordamida aniqlash mumkin. Mendeleev. Ular element joylashgan guruhning soniga va mos ravishda "eng yuqori" oksidlanish darajasi va 8 raqami o'rtasidagi farqga teng.
Agar kimyoviy birikmalarni aniqroq ko'rib chiqsak, qutbsiz bog'lanishga ega bo'lgan moddalarda elementlarning oksidlanish darajasi nolga teng (N 2, H 2, Cl 2).
Elementar holatdagi metallarning oksidlanish darajasi nolga teng, chunki ularda elektron zichligining taqsimlanishi bir xil.
Oddiy ionli birikmalarda ular tarkibiga kiradigan elementlarning oksidlanish darajasi elektr zaryadiga teng, chunki bu birikmalar hosil bo'lishi jarayonida elektronlarning bir atomdan ikkinchisiga deyarli to'liq o'tishi sodir bo'ladi: Na +1 I -1, Mg. +2 Cl -1 2, Al +3 F - 1 3, Zr +4 Br -1 4 .
Qutbli kovalent bog'lanishga ega bo'lgan birikmalardagi elementlarning oksidlanish darajasini aniqlashda ularning elektronegativlik qiymatlari taqqoslanadi. Kimyoviy bog'lanish hosil bo'lganda, elektronlar ko'proq elektron manfiy elementlarning atomlariga ko'chiriladi, ikkinchisi birikmalarda salbiy oksidlanish darajasiga ega.
Faqat bitta oksidlanish darajasi qiymati bilan tavsiflangan elementlar mavjud (ftor, IA va IIA guruhlari metallari va boshqalar). Elektromanfiylikning eng yuqori qiymati bilan tavsiflangan ftor har doim birikmalarda doimiy salbiy oksidlanish darajasiga ega (-1).
Nisbatan past elektromanfiylik qiymati bilan tavsiflangan gidroksidi va ishqoriy tuproq elementlari har doim mos ravishda (+1) va (+2) ga teng ijobiy oksidlanish darajasiga ega.
Shu bilan birga, bir necha oksidlanish darajalari (oltingugurt - (-2), 0, (+2), (+4), (+6) va boshqalar) bilan tavsiflangan kimyoviy elementlar ham mavjud.
Muayyan kimyoviy element uchun qancha va qanday oksidlanish darajalari xarakterli ekanligini eslashni osonlashtirish uchun kimyoviy elementlarning oksidlanish darajalari jadvallaridan foydalaning, ular quyidagicha ko'rinadi:
|
Tartib raqam |
Rus / ingliz Ism |
Kimyoviy belgi |
Oksidlanish holati |
|
Vodorod |
|||
|
Geliy |
|||
|
Litiy |
|||
|
berilliy |
|||
|
(-1), 0, (+1), (+2), (+3) |
|||
|
Uglerod |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
||
|
Azot / Azot |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
||
|
Kislorod |
(-2), (-1), 0, (+1), (+2) |
||
|
Ftor |
|||
|
Natriy / natriy |
|||
|
Magniy / magniy |
|||
|
alyuminiy |
|||
|
Silikon |
(-4), 0, (+2), (+4) |
||
|
Fosfor / Fosfor |
(-3), 0, (+3), (+5) |
||
|
Oltingugurt/oltingugurt |
(-2), 0, (+4), (+6) |
||
|
Xlor |
(-1), 0, (+1), (+3), (+5), (+7), kamdan-kam (+2) va (+4) |
||
|
Argon / Argon |
|||
|
Kaliy / Kaliy |
|||
|
Kaltsiy |
|||
|
Skandiy / Skandiy |
|||
|
Titan |
(+2), (+3), (+4) |
||
|
Vanadiy |
(+2), (+3), (+4), (+5) |
||
|
Chrome / Chromium |
(+2), (+3), (+6) |
||
|
Marganets / Marganets |
(+2), (+3), (+4), (+6), (+7) |
||
|
Temir |
(+2), (+3), kamdan-kam (+4) va (+6) |
||
|
Kobalt |
(+2), (+3), kamdan-kam (+4) |
||
|
Nikel |
(+2), kamdan-kam (+1), (+3) va (+4) |
||
|
Mis |
+1, +2, kamdan-kam (+3) |
||
|
Galiy |
(+3), kamdan-kam (+2) |
||
|
Germaniy / Germaniy |
(-4), (+2), (+4) |
||
|
Arsenik/mishyak |
(-3), (+3), (+5), kamdan-kam (+2) |
||
|
Selen |
(-2), (+4), (+6), kamdan-kam (+2) |
||
|
Brom |
(-1), (+1), (+5), kamdan-kam (+3), (+4) |
||
|
Kripton / Kripton |
|||
|
Rubidiy / Rubidiy |
|||
|
Stronsiy / Stronsiy |
|||
|
Itriy / itriy |
|||
|
Zirkonyum / Zirkonyum |
(+4), kamdan-kam (+2) va (+3) |
||
|
Niobiy / Niobiy |
(+3), (+5), kamdan-kam (+2) va (+4) |
||
|
Molibden |
(+3), (+6), kamdan-kam (+2), (+3) va (+5) |
||
|
Technetium / Technetium |
|||
|
Ruteniy / Ruteniy |
(+3), (+4), (+8), kamdan-kam (+2), (+6) va (+7) |
||
|
Rodiy |
(+4), kamdan-kam (+2), (+3) va (+6) |
||
|
Palladiy |
(+2), (+4), kamdan-kam (+6) |
||
|
Kumush |
(+1), kamdan-kam (+2) va (+3) |
||
|
kadmiy |
(+2), kamdan-kam (+1) |
||
|
Indiy |
(+3), kamdan-kam (+1) va (+2) |
||
|
Qalay/Kalay |
(+2), (+4) |
||
|
Surma / Surma |
(-3), (+3), (+5), kamdan-kam (+4) |
||
|
Tellur / Tellur |
(-2), (+4), (+6), kamdan-kam (+2) |
||
|
(-1), (+1), (+5), (+7), kamdan-kam (+3), (+4) |
|||
|
Ksenon / Ksenon |
|||
|
Seziy |
|||
|
Bariy / bariy |
|||
|
Lantan / Lantan |
|||
|
Seriy |
(+3), (+4) |
||
|
Praseodimiyum / Praseodimiy |
|||
|
Neodimiy / Neodimiy |
(+3), (+4) |
||
|
Prometiy / Prometiy |
|||
|
Samarium / Samarium |
(+3), kamdan-kam (+2) |
||
|
Yevropa |
(+3), kamdan-kam (+2) |
||
|
Gadoliniy / Gadolinium |
|||
|
Terbium / Terbium |
(+3), (+4) |
||
|
Disprosium / Disprosium |
|||
|
Holmiy |
|||
|
Erbium |
|||
|
Tulyum |
(+3), kamdan-kam (+2) |
||
|
Itterbium / İtterbiy |
(+3), kamdan-kam (+2) |
||
|
Lutetiy / Lutetiy |
|||
|
Gafniy / Gafniy |
|||
|
Tantal / Tantal |
(+5), kamdan-kam (+3), (+4) |
||
|
Volfram/Volfram |
(+6), kamdan-kam (+2), (+3), (+4) va (+5) |
||
|
Reniy / Renium |
(+2), (+4), (+6), (+7), kamdan-kam (-1), (+1), (+3), (+5) |
||
|
Osmiy / Osmiy |
(+3), (+4), (+6), (+8), kamdan-kam (+2) |
||
|
Iridium / Iridium |
(+3), (+4), (+6), kamdan-kam (+1) va (+2) |
||
|
Platina |
(+2), (+4), (+6), kamdan-kam (+1) va (+3) |
||
|
Oltin |
(+1), (+3), kamdan-kam (+2) |
||
|
Merkuriy |
(+1), (+2) |
||
|
Taliy / Talyum |
(+1), (+3), kamdan-kam (+2) |
||
|
Qo'rg'oshin / Etakchi |
(+2), (+4) |
||
|
vismut |
(+3), kamdan-kam (+3), (+2), (+4) va (+5) |
||
|
Poloniy |
(+2), (+4), kamdan-kam (-2) va (+6) |
||
|
Astatin |
|||
|
Radon / Radon |
|||
|
Frantsiy |
|||
|
Radiy / Radiy |
|||
|
Aktiniy |
|||
|
Toriy |
|||
|
Proaktiniy / Protaktinium |
|||
|
Uran / Uran |
(+3), (+4), (+6), kamdan-kam (+2) va (+5) |
Muammoni hal qilishga misollar
MISOL 1
- Fosfinda fosforning oksidlanish darajasi (-3), ortofosfor kislotasida esa (+5) ga teng. Fosforning oksidlanish darajasining o'zgarishi: +3 → +5, ya'ni. birinchi javob varianti.
- Oddiy moddadagi kimyoviy elementning oksidlanish darajasi nolga teng. P 2 O 5 tarkibidagi oksiddagi fosforning oksidlanish darajasi (+5). Fosforning oksidlanish darajasining o'zgarishi: 0 → +5, ya'ni. uchinchi javob varianti.
- HPO 3 kislota tarkibidagi fosforning oksidlanish darajasi (+5), H 3 PO 2 esa (+1) ga teng. Fosforning oksidlanish darajasining o'zgarishi: +5 → +1, ya'ni. javobning beshinchi varianti.
2-MISA
| Mashq qilish | Uglerodning birikmadagi oksidlanish darajasi (-3): a) CH 3 Cl; b) C 2 H 2; c) HCOH; d) C 2 H 6. |
| Yechim | Savolga to'g'ri javob berish uchun biz taklif qilingan birikmalarning har birida uglerod oksidlanish darajasini navbatma-navbat aniqlaymiz. a) vodorodning oksidlanish darajasi (+1), xlorniki esa (-1) ga teng. Uglerodning oksidlanish darajasini “x” deb olaylik: x + 3×1 + (-1) =0; Javob noto'g'ri. b) vodorodning oksidlanish darajasi (+1). Uglerodning oksidlanish holatini “y” deb olaylik: 2×y + 2×1 = 0; Javob noto'g'ri. v) vodorodning oksidlanish darajasi (+1), kislorodniki esa (-2) ga teng. Uglerodning oksidlanish darajasini “z” deb olaylik: 1 + z + (-2) +1 = 0: Javob noto'g'ri. d) vodorodning oksidlanish darajasi (+1). Uglerodning oksidlanish holatini “a” deb olaylik: 2×a + 6×1 = 0; To'g'ri javob. |
| Javob | Variant (d) |
Saraton va DPA uchun kimyoviy tayyorgarlik
Keng qamrovli nashr
QISM VA
UMUMIY KIMYO
MADDANING KIMYOVIY BOGLANISHI VA TUZILISHI
Oksidlanish holati
Oksidlanish darajasi - bu molekula yoki kristaldagi atomning shartli zaryadi bo'lib, u tomonidan yaratilgan barcha qutbli aloqalar tabiatda ion bo'lganida paydo bo'ladi.
Valentlikdan farqli o'laroq, oksidlanish darajasi musbat, manfiy yoki nolga teng bo'lishi mumkin. Oddiy ionli birikmalarda oksidlanish darajasi ionlarning zaryadlari bilan mos keladi. Masalan, natriy xloridda
NaCl (Na + Cl - ) Natriyning oksidlanish darajasi +1, xlor esa -1, kaltsiy oksidi CaO (Ca +2 O -2)da kaltsiy +2, oksisen esa -2. Bu qoida barcha asosiy oksidlarga taalluqlidir: metall elementning oksidlanish darajasi metall ionining zaryadiga teng (natriy +1, bariy +2, alyuminiy +3), kislorodning oksidlanish darajasi esa -2 ga teng. Oksidlanish darajasi arab raqamlari bilan ko'rsatiladi, ular valentlik kabi element belgisi ustiga qo'yiladi va birinchi navbatda zaryad belgisi, so'ngra uning raqamli qiymati ko'rsatiladi:Agar oksidlanish darajasining moduli birga teng bo'lsa, u holda "1" raqamini tashlab qo'yish mumkin va faqat belgini yozish mumkin:
Na + Cl -.Oksidlanish soni va valentlik o'zaro bog'liq tushunchalardir. Ko'pgina birikmalarda elementlarning oksidlanish darajasining mutlaq qiymati ularning valentligiga to'g'ri keladi. Biroq, valentlik oksidlanish darajasidan farq qiladigan ko'plab holatlar mavjud.
Oddiy moddalarda - metall bo'lmaganlarda kovalent qutbsiz bog'lanish mavjud bo'lib, umumiy elektron juftligi atomlardan biriga siljiydi, shuning uchun oddiy moddalardagi elementlarning oksidlanish darajasi har doim nolga teng. Ammo atomlar bir-biri bilan bog'langan, ya'ni ular ma'lum bir valentlikni namoyon qiladi, masalan, kislorodda kislorodning valentligi II, azotda azotning valentligi III:
Vodorod peroksid molekulasida kislorodning valentligi ham II, vodorodniki esa I:
Mumkin darajalarning ta'rifi elementlarning oksidlanishi
Oksidlanish shuni ko'rsatadiki, elementlar turli xil birikmalarda namoyon bo'lishi mumkin, aksariyat hollarda tashqi elektron sathning tuzilishi yoki elementning davriy jadvaldagi o'rni bilan aniqlanishi mumkin.
Metall elementlarning atomlari faqat elektronlarni berishi mumkin, shuning uchun ular birikmalarda ijobiy oksidlanish darajasini ko'rsatadi. Ko'p hollarda uning mutlaq qiymati (shundan tashqari d -elementlar) tashqi sathdagi elektronlar soniga, ya'ni davriy sistemadagi guruh raqamiga teng. Atomlar d -elementlar ham yuqori darajadagi, ya'ni to'ldirilmagan elektronlarni berishi mumkin d -orbitallar. Shuning uchun uchun d -elementlar, barcha mumkin bo'lgan oksidlanish darajalarini aniqlashga qaraganda ancha qiyin s- va p-elementlar. Ko'pchilik, desak xato bo'lmaydi d -elementlar tashqi elektron sathidagi elektronlar hisobiga +2 oksidlanish darajasini ko'rsatadi va maksimal oksidlanish darajasi ko'p hollarda guruh soniga teng.
Metall bo'lmagan elementlarning atomlari elementning qaysi atomi bilan bog'lanishlariga qarab, ijobiy va salbiy oksidlanish darajasini ko'rsatishi mumkin. Agar element ko'proq elektron manfiy bo'lsa, u manfiy oksidlanish darajasini, kamroq elektronegativ bo'lsa, ijobiy oksidlanish darajasini ko'rsatadi.
Metall bo'lmagan elementlarning oksidlanish darajasining mutlaq qiymati tashqi elektron qatlamning tuzilishi bilan aniqlanishi mumkin. Atom shu qadar ko'p elektronni qabul qilishga qodirki, uning tashqi sathida sakkizta elektron joylashadi: VII guruhning metall bo'lmagan elementlari bitta elektronni qabul qiladi va -1 oksidlanish darajasini, VI guruh - ikkita elektronni ko'rsatadi va - oksidlanish darajasini ko'rsatadi. 2 va boshqalar.
Metall bo'lmagan elementlar har xil miqdordagi elektronlarni berishga qodir: maksimal tashqi energiya darajasida joylashgan. Boshqacha aytganda, metall bo'lmagan elementlarning maksimal oksidlanish darajasi guruh raqamiga teng. Atomlarning tashqi darajasida elektronlarning aylanishi tufayli atom kimyoviy reaktsiyalarda berishi mumkin bo'lgan juftlashtirilmagan elektronlar soni o'zgaradi, shuning uchun metall bo'lmagan elementlar oksidlanish darajasining turli oraliq qiymatlarini ko'rsatishga qodir.
Mumkin bo'lgan oksidlanish holatlari s- va p-elementlar
|
PS guruhi |
|||||||
|
Eng yuqori oksidlanish darajasi |
|||||||
|
Oraliq oksidlanish darajasi |
|||||||
|
Pastroq oksidlanish darajasi |
Birikmalarda oksidlanish darajalarini aniqlash
Har qanday elektr neytral molekula, shuning uchun barcha elementlar atomlarining oksidlanish darajalari yig'indisi nolga teng bo'lishi kerak. Oltingugurtning (I) oksidlanish darajasini aniqlaymiz. V) oksid SO 2 tafosfor (V) sulfid P 2 S 5.
Oltingugurt (I V) oksidi SO 2 ikki elementning atomlari tomonidan hosil qilingan. Ulardan kislorod eng katta elektronegativlikka ega, shuning uchun kislorod atomlari salbiy oksidlanish holatiga ega bo'ladi. Kislorod uchun u -2 ga teng. Bunday holda, oltingugurt ijobiy oksidlanish holatiga ega. Oltingugurt turli birikmalarda turli oksidlanish darajasini ko'rsatishi mumkin, shuning uchun bu holda uni hisoblash kerak. Bir molekulada SO 2 Oksidlanish darajasi -2 bo'lgan ikkita kislorod atomi, shuning uchun kislorod atomlarining umumiy zaryadi -4 ga teng. Molekulaning elektr neytral bo'lishi uchun oltingugurt atomi ikkala kislorod atomining zaryadini to'liq neytrallashi kerak, shuning uchun oltingugurtning oksidlanish darajasi +4 ga teng:
Molekulada fosfor bor ( V) sulfid P 2 S 5 Elektromanfiy element oltingugurtdir, ya'ni u manfiy oksidlanish darajasini ko'rsatadi, fosfor esa ijobiy oksidlanish holatiga ega. Oltingugurt uchun manfiy oksidlanish darajasi atigi 2. Oltingugurtning besh atomi birgalikda -10 manfiy zaryadga ega. Shuning uchun ikkita fosfor atomi bu zaryadni umumiy zaryad bilan +10 neytrallashi kerak. Molekulada ikkita fosfor atomi bo'lganligi sababli, har birining oksidlanish darajasi +5 bo'lishi kerak:
Ikkilik bo'lmagan birikmalar - tuzlar, asoslar va kislotalarda oksidlanish darajasini hisoblash qiyinroq. Ammo buning uchun siz elektr neytralligi printsipidan ham foydalanishingiz kerak, shuningdek, ko'pgina birikmalarda kislorodning oksidlanish darajasi -2, vodorod +1 ekanligini unutmang.
Keling, buni misol sifatida kaliy sulfat yordamida ko'rib chiqaylik. K2SO4. Kaliyning birikmalardagi oksidlanish darajasi faqat +1 va kislorod -2 bo'lishi mumkin:
Elektr neytralligi printsipidan foydalanib, oltingugurtning oksidlanish darajasini hisoblaymiz:
2(+1) + 1 (x) + 4 (-2) = 0, bundan x = +6.
Birikmalardagi elementlarning oksidlanish darajalarini aniqlashda quyidagi qoidalarga amal qilish kerak:
1. Oddiy moddadagi elementning oksidlanish darajasi nolga teng.
2. Ftor eng elektromanfiy kimyoviy elementdir, shuning uchun barcha birikmalarda ftorning oksidlanish darajasi -1 ga teng.
3. Kislorod ftordan keyin eng elektronegativ element hisoblanadi, shuning uchun ftoridlardan tashqari barcha birikmalarda kislorodning oksidlanish darajasi manfiy: ko'p hollarda -2, peroksidlarda esa -1.
4. Vodorodning oksidlanish darajasi ko'pchilik birikmalarda +1, metall elementlar (gidridlar)li birikmalarda esa -1 ga teng.
5. Metalllarning birikmalardagi oksidlanish darajasi doimo musbat.
6. Elektromanfiyroq element har doim manfiy oksidlanish darajasiga ega.
7. Molekuladagi barcha atomlarning oksidlanish darajalari yig’indisi nolga teng.
Birikmalardagi elementlarning holatini tavsiflash uchun oksidlanish darajasi tushunchasi kiritildi.
TA'RIF
Murakkab tarkibidagi ma'lum element atomidan yoki ma'lum element atomiga ko'chirilgan elektronlar soni deyiladi. oksidlanish darajasi.
Oksidlanishning ijobiy darajasi ma'lum bir atomdan ko'chirilgan elektronlar sonini, manfiy oksidlanish darajasi esa ma'lum bir atom tomon siljigan elektronlar sonini ko'rsatadi.
Bu ta'rifdan kelib chiqadiki, qutbsiz bog'langan birikmalarda elementlarning oksidlanish darajasi nolga teng. Bunday birikmalarga bir xil atomlardan tashkil topgan molekulalarni misol qilib keltirish mumkin (N 2, H 2, Cl 2).
Elementar holatdagi metallarning oksidlanish darajasi nolga teng, chunki ularda elektron zichligining taqsimlanishi bir xil.
Oddiy ionli birikmalarda ular tarkibiga kiradigan elementlarning oksidlanish darajasi elektr zaryadiga teng, chunki bu birikmalar hosil bo'lishi jarayonida elektronlarning bir atomdan ikkinchisiga deyarli to'liq o'tishi sodir bo'ladi: Na +1 I -1, Mg. +2 Cl -1 2, Al +3 F - 1 3, Zr +4 Br -1 4 .
Qutbli kovalent bog'lanishga ega bo'lgan birikmalardagi elementlarning oksidlanish darajasini aniqlashda ularning elektronegativlik qiymatlari taqqoslanadi. Kimyoviy bog'lanish hosil bo'lganda, elektronlar ko'proq elektron manfiy elementlarning atomlariga ko'chiriladi, ikkinchisi birikmalarda salbiy oksidlanish darajasiga ega.
Eng yuqori oksidlanish darajasi
O'z birikmalarida turli oksidlanish darajalarini ko'rsatadigan elementlar uchun eng yuqori (maksimal musbat) va eng past (minimal salbiy) oksidlanish darajalari tushunchalari mavjud. Kimyoviy elementning eng yuqori oksidlanish darajasi odatda D.I.Mendeleyev davriy sistemasidagi guruh raqamiga toʻgʻri keladi. Istisnolar ftor (oksidlanish darajasi -1 va element VIIA guruhda joylashgan), kislorod (oksidlanish darajasi +2 va element VIA guruhda joylashgan), geliy, neon, argon (oksidlanish darajasi 0 va). elementlar VIII guruhda joylashgan), shuningdek, kobalt va nikel kichik guruhining elementlari (oksidlanish darajasi +2, elementlar esa VIII guruhda joylashgan), ular uchun eng yuqori oksidlanish darajasi qiymati bo'lgan son bilan ifodalanadi. ular mansub bo'lgan guruh sonidan pastroq. Mis kichik guruhining elementlari, aksincha, ular I guruhga tegishli bo'lsa-da, birdan kattaroq eng yuqori oksidlanish darajasiga ega (mis va kumushning maksimal ijobiy oksidlanish darajasi +2, oltin +3).
Muammoni hal qilishga misollar
MISOL 1
- Vodorod sulfidida oltingugurtning oksidlanish darajasi (-2) va oddiy moddada - oltingugurt - 0:
Oltingugurtning oksidlanish darajasining o'zgarishi: -2 → 0, ya'ni. oltinchi javob.
- Oddiy moddada - oltingugurtda - oltingugurtning oksidlanish darajasi 0 ga, SO 3 da - (+6):
Oltingugurtning oksidlanish darajasining o'zgarishi: 0 → +6, ya'ni. to'rtinchi javob varianti.
- Oltingugurt kislotasida oltingugurtning oksidlanish darajasi (+4) va oddiy moddada - oltingugurt - 0:
1×2 +x+ 3×(-2) =0;
Oltingugurtning oksidlanish darajasining o'zgarishi: +4 → 0, ya'ni. uchinchi javob varianti.
2-MISA
| Mashq qilish | Azot birikmada III valentlik va oksidlanish darajasini (-3) ko'rsatadi: a) N 2 H 4; b) NH 3; c) NH 4 Cl; d) N 2 O 5 |
| Yechim | Berilgan savolga to'g'ri javob berish uchun taklif qilingan birikmalardagi azotning valentlik va oksidlanish darajasini navbatma-navbat aniqlaymiz. a) vodorodning valentligi doimo I ga teng. Vodorodning valentlik birliklarining umumiy soni 4 ga teng (1 × 4 = 4). Olingan qiymatni molekuladagi azot atomlari soniga ajratamiz: 4/2 = 2, shuning uchun azotning valentligi II ga teng. Bu javob varianti noto'g'ri. b) vodorodning valentligi doimo I ga teng. Vodorod valentligi birliklarining umumiy soni 3 ga teng (1 × 3 = 3). Olingan qiymatni molekuladagi azot atomlari soniga ajratamiz: 3/1 = 2, shuning uchun azotning valentligi III ga teng. Ammiakdagi azotning oksidlanish darajasi (-3): Bu to'g'ri javob. |
| Javob | Variant (b) |